(1)
Institut für Diagnostische und Interventionelle Radiologie, Universitätsspital Zürich, Rämistraße 100 , 8091 Zürich, Schweiz
Zusammenfassung
Das Blutkreislauf-System kann mittels Magnetresonanztomographie auf unterschiedlichen Ebenen untersucht werden. Gefäße lassen sich direkt abbilden (MR-Angiographie, MRA) und im Hinblick auf anatomische Besonderheiten, Verengungen, Ausweitungen oder Dissektionen untersuchen. Dieses Gebiet ist durch die Einführung von Kontrastmitteln stark beeinflusst worden, welche auch zeitaufgelöste Techniken einfacher gemacht haben. Die Magnetresonanz kann nicht nur das Blut in den Gefäßen abbilden, sondern auch Gefäßwände und ihre pathologischen Veränderungen darstellen.
Blutgefäße und Kapillaren mit Durchmessern deutlich <1 mm können normalerweise nicht direkt abgebildet werden. Es ist jedoch möglich, das Signal eines Gewebes vom Grad seiner Durchblutung abhängig zu machen und so relative regionale Unterschiede der Organperfusion direkt sichtbar zu machen.
Im Hirn lässt sich eine durch „Hirnaktivität“ verursachte Veränderung der Sauerstoffsättigung des Kapillarblutes mit der funktionellen MR-Tomographie (fMRI) indirekt beobachten.
Die MR-Bildgebung am Herzen zeichnet sich durch einige Besonderheiten aus. Mit einer Kombination mehrerer MR-Aufnahmen des Herzmuskels können breitgefächerte klinische Fragestellungen beantwortet werden.
Das Blutkreislauf-System kann mittels Magnetresonanztomographie auf unterschiedlichen Ebenen untersucht werden. Gefäße lassen sich direkt abbilden ( MR-Angiographie, MRA) und im Hinblick auf anatomische Besonderheiten, Verengungen, Ausweitungen oder Dissektionen untersuchen. Dieses Gebiet ist durch die Einführung von Kontrastmitteln stark beeinflusst worden, welche auch zeitaufgelöste Techniken einfacher gemacht haben. Die Magnetresonanz kann nicht nur das Blut in den Gefäßen abbilden, sondern auch Gefäßwände und ihre pathologischen Veränderungen darstellen.
Blutgefäße und Kapillaren mit Durchmessern deutlich <1 mm können normalerweise nicht direkt abgebildet werden. Es ist jedoch möglich, das Signal eines Gewebes vom Grad seiner Durchblutung abhängig zu machen und so relative regionale Unterschiede der Organperfusion direkt sichtbar zu machen.
Im Hirn lässt sich eine durch „Hirnaktivität“ verursachte Veränderung der Sauerstoffsättigung des Kapillarblutes mit der funktionellen MR-Tomographie (fMRI) indirekt beobachten.
Die MR-Bildgebung am Herzen zeichnet sich durch einige Besonderheiten aus. Mit einer Kombination mehrerer MR-Aufnahmen des Herzmuskels können breitgefächerte klinische Fragestellungen beantwortet werden.
11.1 Angiographie
Mit einer MR-Angiographie (MRA) versucht man, Gefäße direkt abzubilden und im Hinblick auf anatomische Besonderheiten, Verengungen, Ausweitungen oder Dissektionen zu untersuchen. Die Magnetresonanz kann das Blut in Arterien, Venen und Herzkammern, aber auch Gefäßwände und ihre pathologischen Veränderungen abbilden. Häufig ist der arterielle Gefäßbaum von Interesse und man versucht, ihn selektiv, unter Unterdrückung von Signal aus Venen und Geweben, darzustellen (Arteriographie). Die MR-Angiographie ist durch die Einführung von Kontrastmitteln stark beeinflusst worden, welche auch zeitaufgelöste Untersuchungen vereinfacht haben.
Angiographische Techniken sind dafür optimiert, das Blut und seine Umgebung mit möglichst unterschiedlichen Signalstärken abzubilden. Fünf der vorgestellten Techniken (Time-of-Flight-, Phasenkontrast-, Volumeneinstrom- und Herzphasen-Differenz-MRA, sowie Black-Blood-MRA ) gelingt das, wenn sich das Blut schneller als dessen Umgebung bewegt. Die kontrastmittelunterstützte MRA bildet dagegen Körperregionen hell ab, in denen ein Kontrastmittel die Relaxationszeit der Wasser-Längsmagnetisierung auf Werte <100 ms verkürzt. Kurz nach einer direkten Injektion in das venöse Gefäßsystem ist dies nur in den Blutgefäßen der Fall.
11.1.1 Blutdarstellung mit positivem Kontrast
In der klinischen Routine werden MRA-Techniken, die das Blut hell abbilden, am häufigsten eingesetzt ( Bright-Blood- Techniken). Beispiele werden in den nachfolgenden Kapiteln (▶ Abschn. 11.1.2 bis ▶ 11.1.7) kurz vorgestellt. Positiv kontrastierte Gefäße sind einfacher zu erkennen. Bei der elektronischen Nachverarbeitung können sie zudem mit weniger Aufwand auf Projektionen durch den Datensatz gut sichtbar gemacht werden. Es ist jedoch ein gemeinsamer Nachteil dieser Methoden, dass turbulent fließendes Blut meist kein Signal liefert und deshalb vom Hintergrund nicht kontrastiert dargestellt wird. Davon sind häufig auch wichtige Gefäßabschnitte betroffen, wie z. B. Verzweigungen oder Ausflussbereiche von Verengungen. Das Problem kann im Allgemeinen nur dadurch gemildert werden, dass die Echozeit so kurz wie möglich gehalten wird.
Die angiographischen Verfahren können zwei(2D)- wie auch dreidimensionale (3D-) Datensätze liefern, wobei auch 2D-Bilder in der Nachverarbeitung zu 3D-Volumina kombiniert werden können. 3D-Aufnahmen haben im Allgemeinen den Vorteil, dass dünnere Schichten ohne Schichtabstand abgebildet werden können. Sie können auch in der Nachverarbeitung mit guter Auflösung aus allen Richtungen betrachtet und neu formatiert werden. Bei 2D-Aufnahmen werden die Schichten vorzugsweise senkrecht zur Flussrichtung der interessierenden Gefäße gelegt und der Reihe nach entgegen der Flussrichtung gemessen. So können unerwünschte Sättigungs- und Partialvolumeneffekte minimiert werden (◘ Abb. 11.1).
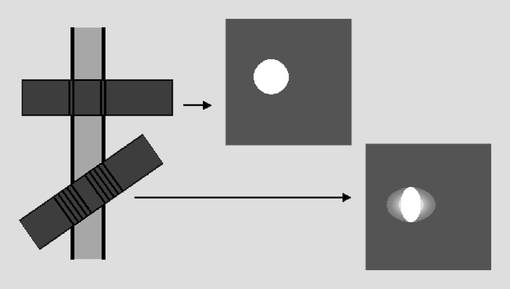
Abb. 11.1
Partialvolumeneffekte beim Kippen der Abbildungsschicht aus der senkrecht auf der Gefäßlängsachse stehenden Ebene. Der Gefäßdurchmesser scheint in der Abbildung der gekippten Ebene verkleinert
11.1.2 Time-of-Flight-Angiographie
Die TOF- MR-Angiographie stellt Blut hell dar, das schnell durch die Abbildungsebene hindurch fließt. Schwerpunktmäßig wird sie heute mit axialer Schichtführung für die Darstellung der Gefäßsysteme in Hals und Kopf eingesetzt (z. B. für die Karotiden und den Circulus arteriosus Willisii ). Sie bleibt aber für Gefäße in allen Körperregionen eine Option.
Der Ausdruck „time of flight“ ist wahrscheinlich von einer Massenspektroskopietechnik übernommen worden, bei der Molekülfragmente mit unterschiedlichen Massen, aufgrund unterschiedlich langer Flugzeiten durch eine Vakuumröhre, voneinander getrennt werden. In der TOF-MRA sind es die Spins der Wassermoleküle, die sich im Blut durch die Gefäße bewegen. Ein Gefäß wird dann hell abgebildet, wenn kontinuierlich Spins in der Abbildungsebene durch neu hereinfließende „frische“ Spins ersetzt werden (In-Flow- oder Einstromeffekt ; ◘ Abb. 11.2).
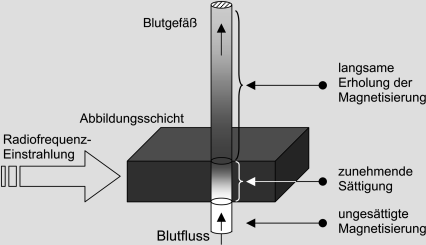
Abb. 11.2
Prinzip der TOF-MR-Angiographie: Die Graustufen reflektieren die Intensität der Längsmagnetisierung
TOF-MRA-Sequenzen sind Gradientenechosequenzen mit kurzen Repetitions- (etwa <50 ms) und möglichst kurzen Echozeiten. Die Pulswinkel variieren von etwa 20–40° in 3D-Aufnahmen bis zu 90° in 2D-Aufnahmen. Die Magnetisierung von Spins, die unbewegt im abgebildeten Volumen ruhen, wird durch die in rascher Folge eingestrahlten Anregungspulse stark gesättigt (◘ Abb. 3.3 und ◘ 3.4). Sie erzeugt nur ein sehr kleines Signal und stationäres Gewebe erscheint im MR-Bild dunkel. Die Magnetisierung von Spins, die mit dem Blut in die Abbildungsebene hineinfließen, ist dagegen noch nicht durch die Anregungspulse beeinträchtigt worden. Sie ist maximal groß und entspricht der Gleichgewichtsmagnetisierung. Nach der Auslenkung durch einen Puls im Abbildungsvolumen erzeugt sie ein entsprechend großes Signal.
Wenn die frisch zugeströmten Spins das Abbildungsvolumen nicht innerhalb einer TR-Periode wieder verlassen, wird ihre Magnetisierung durch nachfolgende Pulse ebenfalls weiter abgesättigt. Ihr MR-Signal wird immer kleiner und das Gefäß kontrastiert sich immer schlechter, je weiter sich beide vom Eintrittsort in die Abbildungsschicht entfernen. Das wird zum Problem, wenn sich das Blut lange im Abbildungsvolumen aufhält bei
langsamem Fluss (Aneurysmen , falsche Lumen , Gefäßwandnähe, Gefäßmalformationen etc.),
kurvigem Gefäßverlauf,
der Messung von dicken Schichten (vor allem 3D-Aufnahmen).
Bis zu einem gewissen Grad kann der zunehmende Signalverlust durch eine allmähliche Vergrößerung des Pulswinkels kompensiert werden, den die Spins auf ihrem Weg durch das Abbildungsvolumen erfahren („ tilted optimized non-saturating excitation“, TONE). Die Aufnahme eines dickeren 3D-Volumens kann auch in die Aufnahme mehrerer dünnerer Subvolumina aufgeteilt werden („multiple overlapping thin slab acquisitions “, MOTSA).
Ein maximaler In-Flow-Effekt wird bei der Aufnahme dünner 2D-Schichten senkrecht zur Flussrichtung eines Gefäßes erzielt. 2D-Aufnahmen können deshalb bei der Untersuchung von Gefäßen mit langsamem Fluss, z. B. im portalvenösen System, vorteilhaft sein.
Probleme mit der Sättigung der Magnetisierung können auch dann entstehen, wenn ein Gefäß nicht geradlinig verläuft, sondern aus der Abbildungsebene heraus- und danach wieder in sie hineinführt. Die Signalintensität in distalen Abschnitten kann dann stark reduziert sein.
Die Signalvergrößerung durch das einfließende Blut hängt nicht davon ab, von welcher Seite her der Einstrom in die Abbildungsschicht erfolgt. Deshalb können Venen in der TOF-MRA nicht ohne weiteres von Arterien unterschieden werden. Hier hilft eine regionale Vorsättigung, bei der die Magnetisierung in einer Schicht distal ( Arteriographie) oder proximal ( Phlebographie) zur Abbildungsschicht vor Beginn der Datenaufnahme vollständig abgesättigt wird. Blut, das aus der Vorsättigungsschicht in das Abbildungsvolumen einströmt, wird dunkel abgebildet (◘ Abb. 11.3).
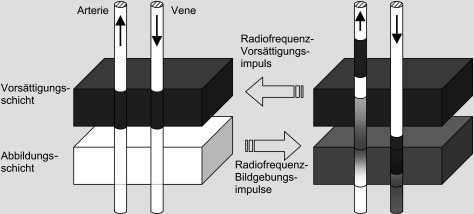
Abb. 11.3
Unterscheidung von Arterien und Venen in der TOF-MR-Angiographie. Nach dem Vorsättigen der Magnetisierung in einer der Abbildungsschicht benachbarten Region hängt die Signalintensität in einem Gefäß stärker von der Blutflussrichtung ab
Die Unterdrückung des Signals von ruhendem Gewebe (z. B. weißer Hirnsubstanz) kann durch die Sättigung der Magnetisierung von mit Makromolekülen in Wechselwirkung tretenden, „gebundenen“ Protonen (▶ Abschn. 3.6) verstärkt werden, was in den meisten Fällen die Kontrastierung der Gefäße verbessert. Auch eine Unterdrückung des Fettsignals kann nützlich sein.
In der Anwesenheit von moderaten Konzentrationen eines MRA-Kontrastmittels ist die Signalintensität der Gefäße höher, die Unterscheidung von Venen und Arterien wird jedoch erschwert.
Bei der Befundung von TOF-MRA-Daten gilt es zu bedenken, dass im Allgemeinen Gefäßdurchmesser unterschätzt und Stenosen tendenziell überschätzt werden, sowie, dass Gefäße mit langsamem Fluss oder kurvigem Verlauf schlecht kontrastiert sein können. Es kann umgekehrt aber auch Gewebe mit außergewöhnlich kurzen Relaxationszeiten, z. B. durch Methämoglobin in subakuten Hämatomen oder Thromben verursacht, unerwartet hell abgebildet werden. Zu den Pluspunkten der TOF-MR-Angiographie zählen deren Robustheit in der Routine und die effiziente Akquisitionszeit.
11.1.3 Phasenkontrastangiographie
Die Phasenkontrastangiographie („phase-contrast angiography “, PCA) stellt Blut hell dar, das in die Richtung eines vom MR-Tomographen erzeugten Gradientenfeldes fließt. Sowohl die Richtung als auch die Stärke des Feldes können bei der Datenaufnahme variiert werden. Damit können die Flussrichtung und auch der Bereich der Flussgeschwindigkeiten definiert werden, für welche die Sequenz empfindlich ist. Für alle abgebildeten Voxel können gemittelte Flussgeschwindigkeiten quantitativ gemessen werden.
2D-Aufnahmen vor und hinter einer Stenose, z. B. durch eine Nierenarterie, senkrecht zur Gefäßlängsachse, erlauben eine Schätzung des Druckabfalls über die Verengung. Mit einer Messung durch die Stenose können zudem die maximale Strömungsgeschwindigkeit und die prozentuale Lumenverengung verifiziert werden.
In einem anderen Beispiel kann mit einer 2D-Schichtführung durch die aufsteigende Aorta, nahe oberhalb der Aortenklappe, eine Verteilung der Ausflussgeschwindigkeiten des Blutes über den Aortenquerschnitt für „alle“ (z. B. 20) Phasen des Herzschlags ermittelt werden. Dazu werden mehrere 2D-Phasenkontrastangiogramme in Synchronisation mit dem Herzrhythmus und in unterschiedlichen Herzphasen aufgenommen („CINE phase contrast imaging “). Solche Daten erlauben eine Schätzung des Herzschlagvolumens und des Herzminutenvolumens. Zudem könnte das Vorliegen einer Aorten klappeninsuffizienz diagnostiziert und das entsprechende Rückfluss- im Verhältnis zum Ausstoßvolumen quantifiziert werden. Aus dem Geschwindigkeitsprofil sind auch Informationen über die an den Gefäßwänden wirkenden Scherkräfte ableitbar.
3D-Phasenkontrastaufnahmen kommen hauptsächlich bei der Abbildung der Gefäße im Kopf zum Einsatz, wobei auch mit einer sagittalen Schichtführung sehr gute Resultate erhalten werden können.
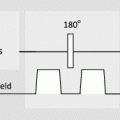
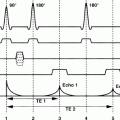
Phasenkontrast-MRA-Sequenzen sind Gradientenechosequenzen mit Repetitionszeiten im Bereich von 10–20 ms und möglichst kurzen Echozeiten (etwa 5–10 ms). Die Sequenzen werden durch ein „ bipolares Gradientenimpulspaar“, das zeitlich zwischen der Hochfrequenzanregung und der Signalaufnahme angelegt wird, auf Flusseffekte empfindlich gemacht (◘ Abb. 11.4). Es bewirkt eine Veränderung der Signalphase von sich bewegenden Spins, während das Signal von stationären Spins unverändert ist (◘ Abb. 11.5).
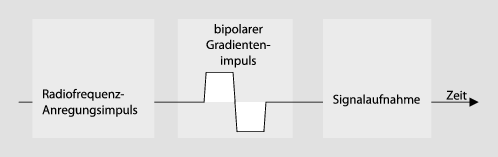
Abb. 11.4
Schematische Darstellung einer Phasenkontrast-MRA-Sequenz
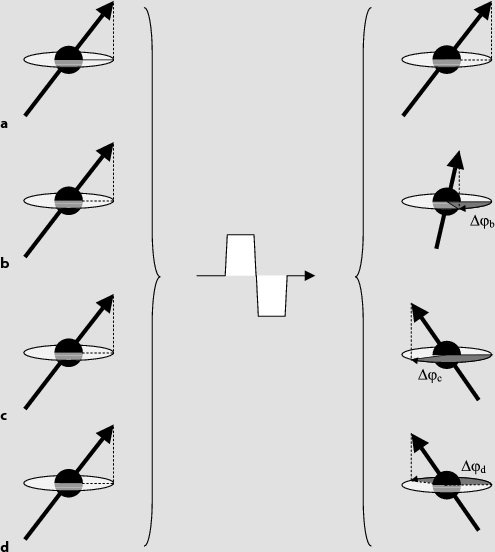
Abb. 11.5a–d
Durch ein bipolares Gradientenimpulspaar verursachte Phasenänderung von ruhenden Spins (a, Δφa=0), langsam entlang des Gradientenfeldes fließenden Spins (b, Δφb>0), schneller fließenden Spins (c, Δφc>Δφb), und schnell in die Gegenrichtung fließenden Spins (d, Δφd=–Δφc). In einem Phasenkontrast-Bild kodiert der Graustufenwert eines Pixels den gemittelten Differenzwinkel, Δφ, der im entsprechenden Voxel gemessen wird
Für Spins, die beide Hälften des Impulspaares am selben Ort erfahren, haben sie nur vernachlässigbare Auswirkungen. Durch den ersten Impuls wird zwar die Feldstärke, die sie erfahren, verändert. Ihre Larmorfrequenz ändert sich proportional und sie drehen sich unterschiedlich weit um das äußere Magnetfeld, je nachdem wo sie sich im Gradientenfeld befinden. Da die Spins während der zweiten Impulshälfte immer noch am selben Ort sind, erfahren sie eine Feldveränderung, deren Betrag genau gleich groß ist wie in der ersten Hälfte, deren Vorzeichen jedoch umgekehrt ist. Spins, die zuvor eine Feldverstärkung erfahren haben und in der Drehung um das Feld vorausgeeilt sind, erfahren jetzt eine gleich starke Feldabschwächung und verlieren ihren Vorsprung in der Drehbewegung wieder. Somit hat die Magnetisierung stationärer Spins nach dem Gradientenimpulspaar dieselbe Phasenlage, so als wären die Gradienten nicht angelegt worden.
Die Situation ist anders, wenn sich Spins verschieben. Wegen des Ortswechsels kann die Feldänderung, die sie während der zweiten Impulspaarhälfte erfahren, keine vollständige Kompensation der Phasenänderung aus der ersten Hälfte mehr bewirken. Die Phase der Magnetisierung bleibt um einen Betrag verändert, der von der Geschwindigkeit abhängt, mit der die Spins entlang der Gradientenrichtung vorankommen. Die Geschwindigkeit lässt sich bei Kenntnis des angelegten Gradientenimpulspaares aus der Phasenänderung berechnen.
Das Vorzeichen der Phasenänderung ist durch die Flussrichtung im Verhältnis zur Gradientenrichtung definiert. Wenn es für Arterien positiv ist (Phasenänderung von 0 bis +180°) und Arterien im MR-Bild hell dargestellt werden, ist es in Venen typischerweise negativ (0 bis –180°) und Venen werden dunkel abgebildet. Oder gerade umgekehrt.
Phasenwinkel zwischen –180° und +180° können ohne weitere Vorkehrungen korrekt den entsprechenden Flussgeschwindigkeiten zugeordnet werden. Wenn sich aber Spins so schnell bewegen, dass sie eine Phasenänderung größer als +180° (z. B. +200°) erfahren, dann wird diese vom Rechner als negative Phasenänderung von –160° interpretiert. Im Bild zeigt sich dies etwa daran, dass ein am Rand hell dargestelltes Gefäß im schnell fließenden Zentrum plötzlich ganz dunkel ist, oder umgekehrt. Dieses Phänomen wird in der Literatur als „phase wrap “ oder „ phase aliasing“ bezeichnet. Es kann durch eine geeignete Wahl des VENC-Parameters („ velocity encoding“) bei der Messung vermieden werden.
Die VENC-Geschwindigkeit sollte auf einen Wert gesetzt werden, der etwas größer ist als die schnellste erwartete Flussgeschwindigkeit im Abbildungsvolumen. Dafür sind einige Vorkenntnisse erforderlich. So variieren arterielle Flussgeschwindigkeiten von wenigen cm•s-1 bis zu über 200 cm•s-1 in der Aorta ascendens. Eine bewusst zu tiefe Wahl der VENC-Geschwindigkeit kann sinnvoll sein, wenn die Empfindlichkeit der Sequenz hinsichtlich kleiner Flussgeschwindigkeiten erhöht werden soll, oder wenn Gefäßdurchmesser möglichst nur wenig unterschätzt werden sollen. Der VENC-Parameter bestimmt die Stärke des bipolaren Gradientenimpulspaares und damit die Proportionalitätskonstante zwischen beobachteter Phasenänderung und Flussgeschwindigkeit.
Die absolute Phasenlage eines MR-Signals hängt von vielen Faktoren und Störfaktoren ab. Deshalb wird in der Phasenkontrast-MRA eine Messung wiederholt, wobei im zweiten Durchgang das bipolare Gradientenimpulspaar verändert wird: Entweder wird die Impulsstärke auf null gesetzt oder ihr Vorzeichen wird umgedreht, so dass ein (+/–)-Impulspaar zu einem (–/+)-Impulspaar wird. Durch Subtraktion der beiden Datensätze kann ein konstanter Fehlbetrag in der Phasenmessung korrigiert werden. Die minimale Messzeit wird dadurch allerdings verlängert.
Mit der Aufnahme von vier Datensätzen, mit variierender Ausrichtung des bipolaren Gradientenimpulspaares, können die drei Komponenten des Flussgeschwindigkeitsvektors quantitativ und fehlerkorrigiert bestimmt werden. So können Datensätze rekonstruiert werden, die fließendes Blut unabhängig von der Flussrichtung hell abbilden, und die anderen Angiographiedatensätzen sehr ähnlich sehen. Solche Phasenkontrastangiogramme haben etwa gegenüber TOF-Angiogrammen den Vorteil, dass die Helligkeit, mit der das Blut abgebildet wird, nicht von der Flussrichtung abhängt, sondern allein durch die Flussgeschwindigkeit bestimmt ist.
In der Anwesenheit von moderaten Konzentrationen eines MRA-Kontrastmittels ist die Signalintensität der Gefäße höher und das SNR verbessert.
Die Aufnahme von 3D-Phasenkontrastangiogrammen mit einer Flusskodierung in drei Raumrichtungen kann zeitaufwändig sein. Schnell fließendes Blut in größeren Arterien und beinahe ruhendes Blut, z. B. in Aneurysmen oder Malformationen, kann nicht in einer einzigen Messung mit guter Empfindlichkeit korrekt abgebildet werden. Auch bei der Phasenkontrastangiographie gilt, dass tendenziell Gefäßdurchmesser unterschätzt und Stenosen überschätzt werden.
Zu den Pluspunkten der Phasenkontrastangiographie zählen die quantitative und örtlich aufgelöste Messung von Flussgeschwindigkeiten und Flussrichtungen, sowie die gute Unterdrückung des Signals stationärer Strukturen.
Phasenkontrast-MRA-Messungen können besser als andere MRA-Techniken für kleine Flussgeschwindigkeiten oder Fluss innerhalb der Abbildungsschicht optimiert werden. Die quantitativen Daten, die die CINE-Phasenkontrastangiographie, mit zeitaufgelösten Geschwindigkeits- und Flussprofilen für verschiedene Phasen des Herzrhythmus liefert, können nicht mit anderen MR-Methoden gewonnen werden.
11.1.4 Volumeneinstromangiographie
Diese Technik sorgt mit geeigneten Sättigungsvorpulsen dafür, dass die Längsmagnetisierung in einem größeren dreidimensionalen Volumen zum Zeitpunkt der anschließenden Signalaufnahme möglichst klein ist. Das Volumen wird dann dunkel abgebildet mit Ausnahme von nicht vorgesättigtem Blut, das erst zwischen Vorsättigung und Signalaufnahme in das Abbildungsvolumen hineingeflossen ist. Mit einer zusätzlichen distalen Vorsättigung von venösem Blut lassen sich Angiographien aufnehmen, in denen sich Arterien auch ohne Bildsubtraktion mit gutem Kontrast hell abbilden.
Als Bildgebungssequenz (nach der Vorsättigung) kommt im Normalfall eine voll ausbalancierte 3D-SSFP-Gradientenechosequenz, seltener eine schnelle 3D-Spinechosequenz zum Einsatz.
Ein gutes Anwendungsbeispiel ist die Darstellung von Nierenarterien , bei Patienten und Patientinnen mit eingeschränkter Nierenfunktion, die möglichst nicht mit Kontrastmittel belastet werden sollten. Bei der graphischen Planung der Aufnahmen mit axialer Schichtführung muss darauf geachtet werden, dass die Oberkante des vorgesättigten Volumens nur knapp oberhalb des Nierenarterienabgangs aus der Aorta platziert wird. Wird das Volumen zu weit nach oben verschoben, muss nicht gesättigtes Blut bis zur Nierenarterie einen weiteren Weg zurücklegen, und wird deshalb schlechter kontrastiert.
Mit dieser Technik kann nur ein deutlich kleinerer Abschnitt des arteriellen Gefäßbaums abgebildet werden als mit einer entsprechenden Kontrastmittelaufnahme. Ein weiterer Nachteil ist die längere Messzeit, die unter anderem aus der Atemsynchronisation der Datenaufnahme resultiert. Die Bildqualität kann in Fällen mit unregelmäßiger Atmung stark kompromittiert sein. Es können aber gelegentlich sogar Verzweigungen einer Nierenarterie oder Oberpolarterien beobachtet werden, die in der kontrastmittelverstärkten Aufnahme nicht deutlich abgebildet sind.
11.1.5 Herzphasendifferenz-Angiographie
Diese Herzphasendifferenztechnik nutzt Unterschiede der Signalintensität von arteriellem Blut in systolischen und diastolischen Phasen des Herzzyklus’ aus. Die Unterschiede werden vor allem in schnellen 3D-Spinechosequenzen deutlich, deren in der Flussrichtung des Blutes angelegte Gradienten verstärkt sind. Sie verursachen einen deutlichen Signalverlust von schnell fließenden Spins aufgrund von entsprechenden Phasenänderungen (▶ Abschn. 11.1.3




Stay updated, free articles. Join our Telegram channel

Full access? Get Clinical Tree