(1)
Guerbet AG, Winterthurerstraße 92 , 8006 Zürich, Schweiz
Zusammenfassung
Die Signalintensitätsdifferenz (SI-Differenz) zweier Gewebe bestimmt im MR den Bildkontrast. Er ist sowohl von intrinsischen (körpereigenen Gewebeeigenschaften) als auch von extrinsischen (gerätespezifischen) Faktoren, insbesondere der verwendeten Pulssequenz, abhängig.
MR-Kontrastmittel sind Pharmazeutika, welche dank Kontrastanhebung und ihrer dynamischen Information (Pharmakokinetik) zur Verbesserung der diagnostischen Aussage (höhere Sensitivität, Spezifität, funktionelle Aussage) in der Kernspintomographie eingesetzt werden. Neben den spezifischen physikochemischen Anforderungen, die sich aus ihrem Einsatz in der MR-Bildgebung ergeben, muss selbstverständlich auch ihr pharmakologisches Profil berücksichtigt werden. Nach ihrem Einsatz sollten MR-Kontrastmittel den Körper rasch wieder verlassen und selbstverständlich möglichst inert (ohne eigene Wirkung) sein.
Bei der Wirkungsweise der MR-Kontrastmittel sind im Prinzip alle bereits besprochenen physikalischen Grundlagen der Kernspintomographie, wie Kernspinresonanz, Spin-Spin-Wechselwirkung, gepulste Anregung mit Relaxation oder auch die magnetischen Eigenschaften einer Substanz, in Betracht zu ziehen. MR-Kontrastmittel verändern die auch sonst spontan ablaufenden Resonanzvorgänge. Dank Signalveränderungen heben sie gewisse Strukturen oder Pathologien hervor. Erklären lässt sich diese differenzierte Darstellung mit unterschiedlichen MR-Eigenschaften der durchfluteten Gewebe:
14.1 Wirkungsweise
Die Signalintensitätsdifferenz (SI-Differenz) zweier Gewebe bestimmt im MR den Bildkontrast. Er ist sowohl von intrinsischen (körpereigenen Gewebeeigenschaften) als auch von extrinsischen (gerätespezifischen) Faktoren, insbesondere der verwendeten Pulssequenz, abhängig.
MR-Kontrastmittel sind Pharmazeutika, welche dank Kontrastanhebung und ihrer dynamischen Information (Pharmakokinetik) zur Verbesserung der diagnostischen Aussage (höhere Sensitivität, Spezifität, funktionelle Aussage) in der Kernspintomographie eingesetzt werden. Neben den spezifischen physikochemischen Anforderungen, die sich aus ihrem Einsatz in der MR-Bildgebung ergeben, muss selbstverständlich auch ihr pharmakologisches Profil berücksichtigt werden. Nach ihrem Einsatz sollten MR-Kontrastmittel den Körper rasch wieder verlassen und selbstverständlich möglichst inert (ohne eigene Wirkung) sein.
Bei der Wirkungsweise der MR-Kontrastmittel sind im Prinzip alle bereits besprochenen physikalischen Grundlagen der Kernspintomographie, wie Kernspinresonanz, Spin-Spin-Wechselwirkung, gepulste Anregung mit Relaxation oder auch die magnetischen Eigenschaften einer Substanz, in Betracht zu ziehen. MR-Kontrastmittel verändern die auch sonst spontan ablaufenden Resonanzvorgänge. Dank Signalveränderungen heben sie gewisse Strukturen oder Pathologien hervor. Erklären lässt sich diese differenzierte Darstellung mit unterschiedlichen MR-Eigenschaften der durchfluteten Gewebe:
Verkürzung der T1- , T2- oder auch T2*-Relaxationszeit ,
Veränderung/Störung der lokalen Magnetfeldhomogenität (Suszeptibilitätseffekte ),
Veränderung der Protonendichte (Anzahl Protonen pro Voxel) eines Gewebes,
Verschiebung der Resonanz- oder Larmorfrequenz .
Welcher Einflussfaktor das Bild dominiert, hängt von der Wahl des eingesetzten Kontrastmittels, der Sequenzgewichtung oder auch physiologischen Parametern ab. Gut veranschaulichen dies die am häufigsten klinisch eingesetzten Gadoliniumkomplexe, die prinzipiell alle drei Relaxationszeiten (T1, T2 und T2*) verkürzen. In der klinischen Praxis wird vor allem die T1-Verkürzung mit entsprechendem Signalanstieg bei der kontrastmittelgestützten MR-Bildgebung ausgenützt. Dies führt bei entsprechender Sequenzwahl mit T1-Gewichtung (kurze Repetitionszeit, kurze Echozeit, angepasste Pulswinkel ) zum Signalanstieg im „kontrastierten“ Gewebe (◘ Abb. 14.1).
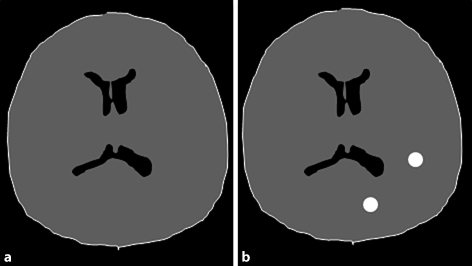
Abb. 14.1a,b
Schematische Darstellung eines T1-gewichteten Nativ-MRT-Bilds (a) sowie eines nach i.v.-Verabreichung von 0,1 mmol Gd/kgKG erzielten Kontrastbilds (ebenfalls T1-gewichtet; b): Zwei Läsionen sind im ZNS nach Kontrastmittelgabe sichtbar geworden. Im Unterschied zum Röntgenkontrastbild (Absorptionsbild) sieht man nicht etwa das Kontrastmittel (also beispielsweise Gd) selbst, sondern dessen Einfluss auf die Relaxationseigenschaften der sie umgebenden Protonen. Der Signalanstieg der Protonen in beiden Läsionen beruht auf der lokalen T1-Verkürzung (Katalyse des Relaxationsenergietransfers) bei extravaskulärer Verteilung des Kontrastmittels innerhalb der Pathologie. Das Kontrastmittel hat die sonst hermetisch dicht verschlossene Blut-Hirn-Schranke passiert. Damit werden alle interstitiellen Bereiche der Läsion, in die das Kontrastmittel sich verteilen kann, sichtbar gemacht
Zum besseren Verständnis der Wirkungsweise von MR-Kontrastmitteln soll auf die einzelnen physikalischen Vorgänge näher eingegangen werden.
14.1.1 Verkürzung der T1- und T2-Relaxationszeiten
Das Kontrastmittel mit seinem permanenten magnetischen Dipolmoment (ungepaarte Elektronenspins = hohe Ladung bezogen auf eine niedrige Masse) beschleunigt (katalysiert, stimuliert) sowohl die T1- (longitudinale Komponente; Spin-Gitter-Relaxation) als auch die T2-Relaxation (transversale Relaxation, skalare, Spin-Spin-, Dipol-Dipol-Wechselwirkung) der sie umgebenden Protonen.
Bei der T1-Relaxation wird die longitudinale Relaxationskomponente, d. h. die bei der Larmoranregung aufgenommene Energie, durch das Kontrastmittel rascher vom Protonenspin auf seine Umgebung transferiert (Energietransfer). Die Energieabgabe führt zu einer rascheren Relaxation der benachbarten Protonen. Gefördert wird dieser Effekt durch fluktuierende Magnetfelder, welche lokal durch die Elektronenspins des Kontrastmittels entstehen. Weil die Protonenspins sich schneller „erholen“, nimmt das Signal bei einer T1-Gewichtung (d. h. bewussten Akquisition der longitudinalen Relaxationskomponente) im MR-Bild zu (◘ Abb. 14.2). Somit werden diese Kontrastmittel als positive Kontrastmittel bezeichnet. Parallel hierzu nimmt auch die Magnetisierung in Z-Richtung wieder zu, da die Protonen vom „antiparallelen“ Energiestatus zunehmend in den „parallelen“ zurückklappen (T1-Kurve; exponentiell). Die spontane, d. h. ohne Kontrastmittel erfolgende Energieabgabe der stimulierten Protonen vollzieht sich im relativ niedrigen RF-Bereich des MR ziemlich langsam (mehrere Sekunden). Nach MR-Kontrastmittelgabe „stimuliert“ sozusagen die Wechselwirkung zwischen angeregten Protonen und lokalen elektromagnetischen Feldern die Energieabgabe mit verkürzten T1- Relaxationszeiten. Dahinter verbirgt sich die Interaktion ungepaarter Elektronenspins des Kontrastmittels mit den umliegenden Wasserstoffkernen (in erster Linie Wasser, dann aber auch Fett- oder Eiweißmoleküle des Gewebes). Somit haben wir es bei MR-Kontrastmitteleffekten streng genommen mit Phänomenen zwischen Elektronenhülle und Atomkernen zu tun. Beispielsweise treten beim Gadolinium mit seinen sieben einzelnen Elektronenspins (◘ Abb. 14.3) Wechselwirkungen mit ihnen nahe kommenden Protonenspins auf. Hierbei werden „innersphärische“ (Wechselwirkung mit fest ans Gadolinium gebundenem Wasser) und „außersphärische“ Phänomene (Wechselwirkung mit ungebundenem, in der Nähe diffundierendem Wasser) unterschieden. Beide Phänomene tragen entscheidend zur Relaxation bei und können u. a. chemisch mit der Komplexstruktur und dem Chelator beeinflusst werden.
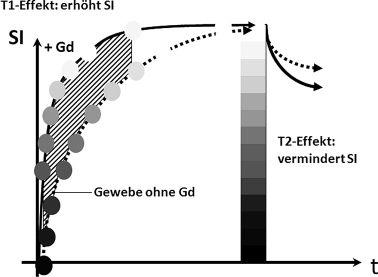
Abb. 14.2
Relaxations-Zeitkurve eines Gewebes mit respektive ohne Gadolinium. Die T1-Verkürzung mit höherem Signal ist nur über einen bestimmten Zeitraum zu erkennen (schraffierter Bereich). Dies entspricht der T1-Gewichtung mit kurzem TR. Bei längeren TR ergibt sich kein Signalintensitätsunterschied (außer bei hohen Konzentrationen aufgrund des zunehmenden T2-Effekts). Gd Gadolnium; SI Signalintensität
Abb. 14.3
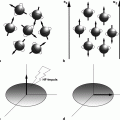
Dank sieben ungepaarten Elektronen in der f-Schale ist Gadolinium stark paramagnetisch
Zeitlich gesehen dominant sind bei der Relaxation gelöster und damit frei beweglicher Protonen die Dipol-Dipol-Wechselwirkungen, die sich auf die transversale Relaxation auswirken (T2<T1). Der Abbau dieser zum Feld senkrechten Polarisation geht schneller vonstatten, da kein Energieaustausch nötig ist. MR-Kontrastmittel verstärken die bei T2-Gewichtung erkennbaren Spin-Spin-Effekte, die zu einer rascheren Dephasierung und somit Beschleunigung der Phaseninkohärenz (Verkürzung der T2-Relaxation) führen. Dies führt zu einer Signalabnahme besonders auf T2-gewichteten Pulssequenzen. Voraussetzung sind ein hohes magnetisches Moment, welches bei ungepaarten Elektronen etwa 657-mal stärker als bei den Protonen ist. Zudem muss bei der Larmorfrequenz , die allerdings von der Feldstärke abhängt, eine Spin-Transition oder Anregung der Elektronen möglich sein. Eine langsame Spin-Relaxationszeit der Kontrastmittelelektronen begünstigt ebenfalls die Dipol-Dipol-Wechselwirkungen. Schließlich ist auch eine gewisse räumliche Nähe entscheidend, die wiederum strukturabhängig ist (▶ Abschn. 14.3). Gadolinium mit seinen sieben ungepaarten Elektronen, 7/2-Spins und einer relativ langen Elektronen-Spin-Relaxationszeit weist auch bezüglich der T2-Relaxation optimale Voraussetzungen auf.
Bei hohen Kontrastmittelkonzentrationen, z. B. in den ableitenden Harnwegen oder Fehlverdünnungen in der MR-Arthrographie, kommt es zunehmend zu einer Dominanz des rascheren T2-Effekts, weshalb das Signal abnimmt, besonders auf T2-gewichteten Bildern, aber auch auf T1- gewichteten Pulssequenzen (◘ Abb. 14.2). Dies kann bei Perfusionsuntersuchungen klinisch genutzt werden, denn dank ausgeprägtem und dosisabhängigen T2/T2*-Signalabfall beim „first pass “ (erster arterieller KM-Durchgang) durch die Gefäße und das gut vaskularisierte Gewebe kann die Perfusion oder Durchblutung eines Zielgewebes genauer gemessen werden.
MR-Kontrastmittel weisen bei niedrigen Konzentrationen eine Dominanz des T1-Effektes mit Signalanstieg auf. Ab einer Schwellendosis kommt es auf Grund zunehmender T2-Effekte zu einem dosisabhängigen Signalabfall (◘ Abb. 14.4).
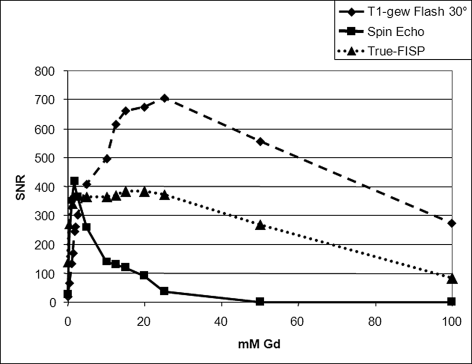
Abb. 14.4
Bei 1,5 T gemessene Dosis-Wirkungs-Kurve der Signalstärke von extrazelluärem Kontrastmittel (Gd-DOTA) bei drei unterschiedlichen Pulssequenzen: Spinechosequenz, Flash = Gradientenechosequenz, True-Fisp = Steady-State-Free-Precession-Sequenz. Man achte auf die je nach Pulssequenz sich deutlich unterscheidenden Gd-Konzentrationen (X-Achse) mit maximalem SNR
Aus mechanistischer Sicht sollten die T1- (longitudinal, Spin-Gitter-Energieabsorption) aber auch die T2-Relaxation (transversal, Dipol-Dipol-Wechselwirkung) von der ebenfalls zum Signalabfall führenden T2*-Relaxation (= Suszeptibilitätseffekt), die praktisch überlagert durch paramagnetische, superparamagnetische oder ferromagnetische MR-Kontrastmittel provoziert wird, differenziert werden (s. u.). Der T2*-Effekt lässt sich durch lokale Feldinhomogenität aufgrund von Suszeptibilität erklären (▶ beschleunigte Dephasierung aufgrund von Suszeptibilitätseffekten).
Die Bedeutung des Umgebungseinflusses erkennt man gut an der unterschiedlichen Relaxationsdauer:
im Vakuum spontane Relaxation in 1016 Jahren,
in einer wässrigen Lösung in ~1 s,
in einer wässrigen Kontrastmittellösung in wenigen ms.
Das unterschiedliche Signal im kontrastmitteldurchfluteten Gewebe (im Allgemeinen in der T1-Wichtung ein deutlich höheres Signal, in der T2-Wichtung bei höheren Konzentrationen ein niedrigeres Signal) beruht also auf unterschiedlichen Relaxationszeiten gegenüber Gewebe ohne Kontrastmittelaufnahme (◘ Abb. 14.2). Auf den Bildern erkennbar wird dies allerdings erst unter der Voraussetzung, dass die richtige Pulssequenz oder Bildgewichtung (z. B. bei Gd vorwiegend eine T1-Gewichtung mit kurzen TR) sowie eine entsprechende Kontrastmittelverteilung vorliegen. Praktisch gesehen wählt man durch die Einstellung der Sequenzparameter einen bestimmten Abszissen-Kurvenschnittpunkt auf der Relaxations-Zeitkurve (◘ Abb. 14.2) mit entsprechendem Kontrast. Lange Repetitionszeiten erhöhen zwar das Signal, verringern aber zunehmend den Kontrast; längere Echozeiten hingegen führen zu erhöhter T2-Wichtung und entsprechendem Signalabfall. Auch hier ist bei sehr langen Echozeiten mit einem Kontrastverlust zu rechnen. Praktische Beispiele für Relaxationsbeschleuniger sind die klinisch eingesetzten Gadolinium- oder Eisenverbindungen.
14.1.2 Beschleunigung der Dephasierung durch lokale Feldinhomogenitäten
Aufgrund des hohen B0-Magnetfelds werden paramagnetische, superparamagnetische oder auch ferromagnetische Kontrastmittel im MR-Gerät positiv magnetisiert. Diese induzierten positiven Magnetfelder führen dort, wo sich das Kontrastmittel ansammelt, zu einer Störung des sonst homogenen Feldes , was die T2-Dephasierung der Protonen über die normale FID-Relaxation hinaus beschleunigt. Die zusätzliche Verkürzung der T2-Zeit wird deshalb auch als T2*-Zeit oder Suszeptibilitätseffekt bezeichnet. Auf T2-gewichteten Sequenzen führt das Kontrastmittel zu sogenannten T2*-Effekten, die das Signal weiter reduzieren. Man bezeichnet sie deshalb als negative Kontrastmittel . Praktische Beispiele sind die superparamagnetischen Eisenoxidnanopartikel („superparamagnetic iron oxide“, SPIO, als orale MR- oder früher als leber- oder auch retikuloendothelialspezifische Leberkontrastmittel), die das Signal deutlich reduzieren. Ähnliche Phänomene können auch zu Artefakten führen (▶ Metallartefakte). T2*-Effekte werden bei hohen Feldstärken, wechselnden Gradientenfeldern, langen Echozeiten und an Grenzflächen begünstigt.
14.1.3 Beeinflussung der Spin- oder Protonendichte
Die Anzahl Protonen pro Voxel (Protonendichte ) hat einen direkten Einfluss auf das Signal. Je mehr Protonen angeregt werden können, desto höher fällt das Signal aus. Kontrastmittel können die Protonenzahl durch eine Verdrängung oder Verschiebung des vorhandenen Wassers verändern. Praktisch gesehen erfolgt am häufigsten eine Reduktion der Protonenzahl z. B. mittels freonartiger Verbindungen wie Perfluorooctylbromid (PFOB), Bariumsulfat oder auch Fettemulsionen etc. Daraus ergibt sich aufgrund der niedrigeren lokalen Protonendichte ein Signalverlust z. B. nach oraler Gabe von Bariumsulfat-Suspensionen.
14.1.4 Verschieben der Resonanzfrequenz
Ähnlich wie bei der chemischen Verschiebung (Fett – Wasser) verursachen gewisse Kontrastmittel eine Verschiebung der Resonanzfrequenz ( Dysprosium) der sie umgebenden Protonen um mehrere hundert ppm. Hierdurch kommt es zu einer Abnahme des messbaren Protonensignals. Dies ist von Dysprosiumverbindungen her bekannt, wird aber aktuell in der klinischen Praxis nicht eingesetzt.
14.2 Chemische Struktur/Komplexchemie
14.2.1 Pharmakokinetik
Substanzen mit hoher Anzahl singulärer Spins und entsprechender Magnetfeldinduktion [ Radikale; (super)paramagnetische Metalle] eignen sich als MR Kontrastmittel. Aus chemischer Sicht handelt es sich bei den klinisch eingesetzten MR-Kontrastmitteln um Gadoliniumlösungen respektive Eisenoxidnanopartikel . Früher wurden auch Manganlösungen klinisch verwendet. Das zu den seltenen Erden (Lanthanoide) gehörende Gadolinium weist in gelöster Form (Gd3+) sieben singuläre Elektronenspins auf (◘ Abb. 14.3). Dies erklärt die hohen Dipol-Dipol- und Dipol-Gitter-Wechselwirkungen neben seinen paramagnetischen Eigenschaften.
Die relativ ausgeprägte Giftigkeit des Gadoliniums (z. B. als Gadoliniumchlorid) beruht auf einem praktisch identischen Ionendurchmesser (1,08 Å) verglichen mit Kalzium (1,14 Å). Damit blockiert gelöstes oder freies Gadolinium zahlreiche im Körper vom Kalzium abhängige Prozesse (Zellatmung, Muskelaktivität, Blutgerinnung, Transmission von Nervenimpulsen, Enzymfunktionen, zytokingesteuerte Transkription). Gd3+ ist einer der wirksamsten Kalziumantagonisten. Bei pH-Werten >6,4 fällt Gadolinium zudem als unlösliches Gadoliniumhydroxid oder -phosphat aus. Die entstehenden Partikel werden von Makrophagen (u. a. Kupffersternzelle, Histiozyten) endozytiert , was zu einer erhöhten Aufnahme durch das unspezifische Immunsystem führt. Damit verteilt sich frei werdendes Gadolinium (Gd3+) bevorzugt in makrophagenartigen Zellen und typischen Speicherorganen wie Leber, Milz oder auch Knochenmark.
Damit Gadolinium nicht in freier Form in den Körper gelangt, d. h. zur Reduktion seiner Toxizität sowie zur Optimierung seiner Kinetik, wird es an Chelatliganden gebunden. Der entstehende Gadoliniumkomplex (rechte Seite der Reaktionsgleichung) steht im Gleichgewicht mit den beiden freien Komponenten (linke Seite), wobei das Gleichgewicht in der Regel deutlich nach rechts verschoben ist:
Gd + Chelatligand  Gadoliniumkomplex
Gadoliniumkomplex
 Gadoliniumkomplex
GadoliniumkomplexFreies Gadolinium in gelöster Form weist dank seiner Ähnlichkeit mit Kalziumionen eine hohe Toxizität auf, während komplex gebundenes Gadolinium als gut verträglich, nierengängig und rasch eliminierbar kennzeichnet ist.
Klinisch eingesetzt werden Gadoliniumkomplexe , die aus Chelatliganden (mehrzähnige Liganden: -DTPA, -DOTA, -DTPA-BMA, -HP-DO3 A, -BT-DO3 A, -BOPTA. DTPA-BMEA, -EOB-DTPA), die sich möglichst fest und spezifisch an das Zentralatom, hier also an Gadolinium binden (◘ Abb. 14.5), bestehen. Die Gadoliniumkomplexe weisen eine hohe Wasserlöslichkeit und damit eine vaskulär-interstitielle Verteilung bei vorwiegend renaler Elimination auf. Die Chelatliganden steuern die Pharmakokinetik. Unterschieden werden ringförmige Liganden (wie -DOTA, -BT-DO3A, -HP-DO3A), die auch als Makrozyklen bezeichnet werden sowie lineare – lang gestreckte (wie -DTPA, ‑DTPA-BMA, -BOPTA, -DTPA-BMEA, -EOB-DTPA), die sich dank ihren zahlreichen Koordinationsstellen Schritt für Schritt um das Zentralatom legen. Die Bindung des Zentralions erfolgt sowohl durch ionische Bindungen zwischen den negativ geladenen Säuregruppen und Gadolinium als auch durch Van-der-Waals-Kräfte zwischen den Stickstoffelektronenpaaren und Gadolinium. Die Anzahl solcher Bindungen oder Koordinationsstellen wird auch als Zähnigkeit bezeichnet. Da ionische Bindungen thermodynamisch gesehen stärker sind, hängt die Komplexstabilität (▶ Abschn. 14.2.2) u. a. von der Anzahl ionischer Bindungen und Ionizität des Komplexes als Ganzes ab.
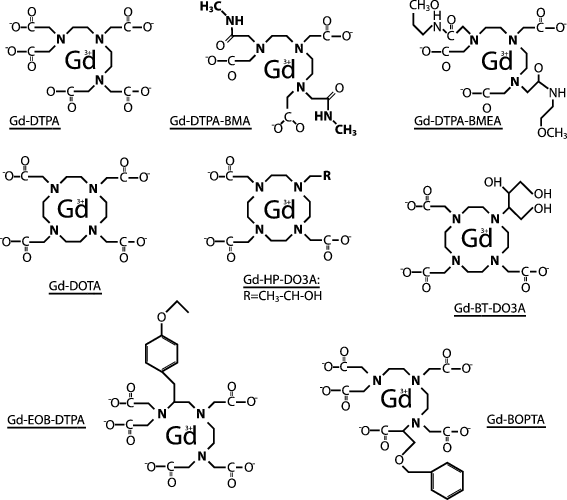
Abb. 14.5
Strukturformel der Gadoliniumkomplexe (lineare Strukturen: Gd-DTPA, Gd-DTPA-BMA, Gd-DTPA-BMEA, Gd-BOPTA, Gd-EOB-DTPA; makrozyklische Struktur: Gd-DOTA, Gd-HP-DO3A, Gd-BT-DO3A). Die beiden reversibel proteinbindenden Gd-BOPTA und Gd-EOB-DTPA weisen eine hydrophobe Seitenkette mit Benzylring auf. Diese Seitenkette führt zudem zur Aufnahme durch die Hepatozyten und partiellen hepatobiliären Elimination (▶ Abschn. 14.5.1). Bei den übrigen handelt es sich um unspezifische Gadoliniumkomplexe mit renaler Elimination
In den meisten der kommerziell erhältlichen Kontrastmittellösungen wird durch die Überschussgabe freier Chelatliganden (meist als Ca/Na-Komplex) eine zusätzliche Absicherung hinsichtlich Gadoliniumfreisetzung erreicht. Die Liganden fangen eventuell freiwerdendes Gadolinium frühzeitig ab. Außerdem verschieben sie das Gleichgewicht nach rechts in Richtung Gadoliniumkomplex anstelle der Dissoziation (▶ Reaktionsgleichung; Rechtsverschiebung).
Gadolinium als Zentralatom weist drei positive Ladungen auf, während der Chelatligand drei bis fünf negative Ladungen aufweist. Je nach Chelatligand muss die Gesamtladung mit Hilfe eines positiv geladenen Zuckermonomerzusatzes (Meglumin+, Methylglukamin+) oder Natrium+ in der Lösung ausgeglichen werden. Entsprechend werden ionische, geladene (z. B. Gd-DOTA–, Gd-DTPA2-, Gd-BOPTA2-, alle mit Megluminzusatz) und nichtionische, neutrale Komplexe (z. B. Gd-DTPA-BMA, Gd-HP-DO3A, Gd-BT-DO3A, Gd-DTPA-BMEA) unterschieden. Der Begriff „ nichtionisch“, welcher sich hier auf die Gesamtladung des Gadoliniumkomplexes bezieht, kann nicht mit den Eigenschaften von Röntgenkontrastmitteln wie eine geringere Neurotoxizität oder bessere Verträglichkeit assoziiert werden.
14.2.2 Thermodynamische Stabilität
Die oben gezeigte Komplexbindung stellt einen reversiblen Vorgang dar, d. h. es findet laufend ein Gleichgewicht zwischen freier (linke Seite = Dissoziation) und gebundener Form (rechte Seite = Komplexbindung, Assoziation) statt. Das Gleichgewicht ist üblicherweise aufgrund der günstigeren Bindungseigenschaften und Energie deutlich nach rechts verschoben. Das Maß für dieses Gleichgewicht wird als „thermodynamische Stabilität “ (logK) bezeichnet. Man spricht auch von der Komplexbildungskonstante (entsprechend dem Massenwirkungsgesetz):
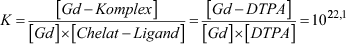
Je höher der Wert für K, desto stabiler ist der Komplex; umgekehrt bei niedrigem K-Wert kommt es rascher zur Dissoziation, d. h. Freisetzung der einzelnen Komponenten (Linksverschiebung in der oberen Reaktionsgleichung). Praktisch gesehen bedeutet der K-Wert, dass man pro 1022,1-Komplexe ein freies Gadoliniumion respektive DTPA2- nachweisen kann (In-vitro-Simulation). Dies hängt u. a. auch vom pH der Lösung ab. Bei einem pH = 7,4 fällt logK von Gd-DTPA auf 17,7 zurück; das Gleichgewicht verschiebt sich in Richtung Dissoziation mit höherem freien Anteil an Gadolinium und DTPA. Die thermodynamische Stabilität bei pH 7,4 wird als „konditionelle Stabilität“ bezeichnet. Schließlich vergleicht man noch die „kinetische Stabilität“ bei einem saurem pH von 1,0 (in 0,1 N Salzsäure HCl), wobei es um die Zeitdauer geht, bis die Hälfte aller Komplexe dissoziiert oder freigesetzt wird (Dissoziations-Halbwertszeit). Die einzelnen Gadoliniumkomplexe unterscheiden sich deutlich hinsichtlich ihrer Komplexstabilität (◘ Tab. 14.1).
Tab. 14.1
Übersicht der in der klinischen Routine eingeführten MR-Kontrastmittel inkl. ihrer Eigenschaften
Marke | DCI | Komplex Konzentration | Element | Indikation | Relaxivität (1,5 T in Wasser) | Osmolalität (37 °C, Osm/kg H2O) | Stabilität | Zusatz in Formel | Bemerkung |
|---|---|---|---|---|---|---|---|---|---|
Ablavar (früher: Vasovist) | Gadofosveset-trinatrium | MS-325 0,25 mol/l | Gd3+ | Angiographie | r1=5,2; 19 (Blutplasma) r2=5,1; 34 (Blutplasma) | 825 | Log Ktherm=18,9 Log Kcond=22,1 | Fosveset Ligand 0,325 mmol/l | Blood Pool Agent 80–87 % reversible Proteinbindung Dosis: 0,03 mmol/kgKG Lange Eliminations-HWZ: 16,3±2,6 h |
Artirem | Wie Dotarem | Gd-DOTA 0,0025 mol/l | Gd3+ | Arthrographie | s. u. | 250–320 | Identischer Wirkstoff wie Dotarem, intraartikuläre Anwendung | ||
Dotarem | Gadotersäure, Meglumin | Gd-DOTA 0,5 mol/l | Gd3+ | ZNS, Ganzkörper, Angiographie | r1=2,9 r2=3,2 | 1350 | Log Ktherm=19,3 Log Kcond=25,6 | Unspezifisches wasserlösliches KM | |
Gadovist | Gadobutrol | Gd-BT-DO3A 1,0 mol/l | Gd3+ | Perfusion, ZNS, Angiographie | r1=3,3 r2=3,9 | 1603 | Log Ktherm=14,7 Log Kcond=21,8 | Na-Ca-Butrol | Unspezifisches wasserlösliches KM Doppelte Konzentration durch Halbierung von Volumen oder Injektionsrate |
Lumirem (Gastro-mark) | Ferum-oxsilum | FeO 0,175 mg Fe/ml | FeO | Gastrointestinaltrakt (oral, rektal) | 250 | E110, E216, E218, Monoammonii glyzyrrhizinas, Sorbitol, Saccharin Na, Carboxymethylzellulose | Negatives orales MR-KM oral oder rektal 300–900 ml | ||
Magnevist | Gadopentetat, Dimeglumin | Gd-DTPA 0,5 mol/l | Gd3+ | ZNS, Ganzkörper, Angiographie | r1=3,3 r2=3,9 | 1940 | Log Ktherm=17,7 Log Kcond=22,1 | 0,2 % Dimgl.-DTPA | Unspezifisches wasserlösliches KM |
Magnevist 2 | Wie Magnevist | Gd-DTPA 0,002 mol/l | Gd3+ | Arthrographie | 290 | Intraartikuläre Anwendung | |||
Multihance | Gadobenat, Dimeglumin | Gd-BOPTA 0,5 mol/l | Gd3+ | Leber, ZNS, Angiographie | r1=4,0; r1= 6,3 (Blutplasma) r2=4,3; r2=8,7 (Blutplasma) | 1970 | Log Ktherm=18,4 Log Kcond=22,6 | Leber: hepatozytenspezifisch Niedrige Albuminbindung Freisetzung von Benzylalkohol | |
Omniscan | Gadodiamid | Gd-DTPA-BMA 0,5 mol/l | Gd3+ | ZNS, Ganzkörper, Angiographie | r1=3,3 r2=3,6 | 790 | Log Ktherm=14,9 Log Kcond=16,9 | 5 % CaNa-DTPA-BMA | Unspezifisches wasserlösliches |
Optimark | Gadover-setamide-bisamid | Gd-DTPA-BMEA 0,5 mol/l | Gd3+ | ZNS, Leber | r1=3,8 r2=4,2 | 1110 | Log Ktherm=15,0 Log Kcond=16,6 | 0,05 mol/l CaNa-versetamid, CaCl2 | Unspezifisches wasserlösliches Nur als Einzeldosis zugelassen |
Primovist | Gadoxetsäure, Dinatrium | Gd-EOB-DTPA 0,25 mol/l | Gd3+ | Leber | r1=4,7; r1=6,9 (Blutplasma) r2=5,1; r2=8,7 (Blutplasma) | 690 | Log Ktherm=18,7 Log Kcond=23,46 | Caloxetsäure Trinatrium, Trometamol | Leber: hepatozytenspezifisch 11 % Proteinbindung Dosis: 0,1 ml/kgKG 10–120 min Vorsicht bei Leberinsuffizienz |
Prohance | Gadoteridol | Gd-HP-DO3A 0,5 mol/l | Gd3+ | ZNS, Ganzkörper, Angiographie | r1=2,9 r2=3,2 | 630 | Log Ktherm=17,1 Log Kcond=23,8 | 0,1 % Ca-HP-DO3A | Unspezifisches wasserlösliches |
Resovist (Japan) | Ferucarbotran | 28 mg Fe/ml |