(1)
Schule für Gesundheitsberufe, Bereich MTRA, Klinikum Dortmund gGmbH, Dortmund, Deutschland
(2)
Bremener Str. 40, 46145 Oberhausen, Deutschland
(3)
Möhnesee, Deutschland
Frau Gerdes, eine 62-jährige Patientin mit diagnostizierten Mamma-Ca, ist zum CT-Staging bei Ihnen. Sie hat vorher noch nie eine Untersuchung mit Kontrastmittel mitmachen müssen und ist sichtlich aufgeregt. Sie reden ruhig und freundlich mit Frau Gerdes über die Untersuchung und erklären ihr, was Sie gerade machen und wie die Untersuchung ablaufen wird. Frau Gerdes wird ruhiger und lacht zwischenzeitlich sogar erleichtert. Die Untersuchung wird durchgeführt. Als sie danach versucht aufzustehen, berichtet Frau Gerdes über Schwindel, Unwohlsein und Kratzen im Hals. Binnen weniger Minuten wird die Patientin zunehmend unruhiger, beklagt nun noch Hautjucken und Atembeschwerden.
?
1. Was sind Ihre ersten Maßnahmen am Patienten?
2.
Wen verständigen Sie?
3.
Welche Utensilien sollten griffbereit liegen?
8.1 Allgemeine Pharmakologie
M. Kahl-Scholz4
(4)
Möhnesee, Deutschland
Die Pharmakologie beschreibt die Wechselwirkung zwischen Stoffen und Lebewesen. Dabei ist interessant, welche Umwandlungsprozesse ein Stoff im gesamten durchläuft (Pharmakokinetik ) und welche Wirkung ein Stoff an seinem Wirkort entfaltet (Pharmakodynamik ), Abb. 8.1. Im Folgenden wird kurz auf diese Aspekte eingegangen. Auch die wichtigsten, für die MTRA-Praxis relevanten Wirkstoffgruppen werden behandelt.
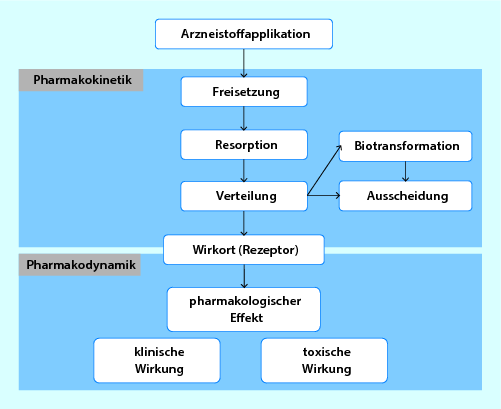
Abb. 8.1
Prozesse der Pharmakokinetik und -dynamik. Pharmakokinetik erfasst alle Vorgänge von der Arzneimittelapplikation bis zur Ausscheidung eines Pharmakons. Die Pharmakodynamik untersucht die Wechselwirkung von Arzneistoffen mit ihren Wirkorten, z. B. Rezeptoren und der Umsetzung in biologische Wirkungen. (Aus Hein 2011)
8.1.1 Pharmakokinetik
Die Kinetik eines Arzneimittels wird durch alle Prozesse ausgemacht, die das Pharmakon im Körper durchläuft (Abb. 8.1). Dazu zählen
Freisetzung (= Liberation). In vielen Fällen muss der Arzneistoff aus dem Arzneimittel selbst erst freigesetzt werden. Dieser Schritt ist häufig derjenige, der am stärksten ausmacht, wie schnell ein Pharmakon wirkt. Eine Wirkung kann schnell gewünscht sein (Tabletten, Brausetabletten), verzögert (z. B. magensaftresistente Tabletten) oder verlangsamt (z. B. Retardtabletten). In Abb. 8.2 ist als Beispiel die Pharmakokinetik unterschiedlicher Insuline dargestellt: Einige wirken schnell, andere gewollt über einen längeren Zeitraum, erreichen dabei aber nicht die Spitzenkonzentration der kurzwirksamen.
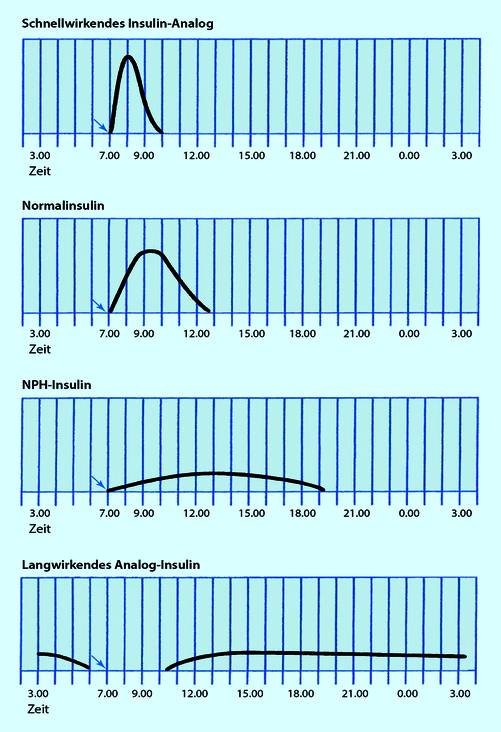
Abb. 8.2
Pharmakokinetische Freisetzung von unterschiedlichen Insulinen. (Aus Piper 2013)
Aufnahme (= Resorption). Dieser Vorgang beschreibt die Aufnahme des Arzneimittels vom Applikationsort (Magen-Darm-Trakt, Rektum, Haut, Alveolen, Nasenschleimhaut etc.) in die Blutbahn. Die Aufnahme ist abhängig von der Größe, Durchblutung und Kontaktzeit mit der Resorptionsfläche (aufgrund der geringeren Kontaktzeit und der gestörten Resorption vermindert z. B. eine Durchfallerkrankung die Aufnahme von Tabletten).
Verteilung (= Distribution). N achdem der Wirkstoff in die Blutbahn gelangt ist, erfolgt seine Verteilung in die Flüssigkeiten und Gewebe des Körpers. Sie ist abhängig von der Löslichkeit des Pharmakons, seiner chemischen Struktur und Eigenschaften, wie z. B. der Proteinbindungsfähigkeit.
Biotransformation (= Metabolismus). Hierzu zählen die biochemischen Um- und Abbauprozesse, denen das Pharmakon im Körper unterliegt. Prinzipiell werden Phase-I-Reaktionen, die der Wirkungsfreisetzung dienen, von Phase-II-Reaktionen, die die Ausscheidung des Pharmakons beschleunigen, unterschieden.
Ausscheidung (= Exkretion). Die Ausscheidung von Arzneimitteln erfolgt meistens über die Niere bzw. mit dem Urin. Teilweise erfolgt auch eine Ausscheidung über die Gallenflüssigkeit und den Stuhl. Wird die Gallenflüssigkeit (und damit der abgebaute Teil des Pharmakons) im Darm wieder resorbiert, redet man vom enterohepatischen Kreislauf.
8.1.2 Pharmakodynamik
Die Pharmakodynamik beschreibt die Wirkung, die ein Arzneimittel am Wirkort erzielt (Abb. 8.1).
Das Wirkprofil eines Medikamentes ergibt sich dabei über die Wirkungsweise und den Wirkort des Arzneimittels – also: Welchen Effekt hat das Pharmakon? An welchen Organen wirkt es?
Ein weiterer wichtiger Begriff in der Pharmakodynamik ist die Dosis-Wirkungs-Beziehung, durch die beschrieben wird, wie viel von einem Arzneimittel nötig ist, um eine Wirkung zu erzielen. Aber auch: Verstärkt sich die Wirkung durch eine höhere Dosis?
Unter einer geringen therapeutischen Breite eines Medikamentes versteht man z. B., dass die Dosis, die man benötigt, um eine Wirkung zu erzielen, sehr nah an der Dosis liegt, die bereits toxisch wirken würde.
Der Wirkmechanismus beschreibt die chemischen Vorgänge (Rezeptorenbindung, Enzymveränderungen etc.), durch den die Wirkung des Arzneimittels zustande kommt.
8.1.3 Begriffe rund um ein Medikament
Wirkstoffgruppe/Wirkung
Jedes Medikament wird einer bestimmten Wirkstoffgruppe zugeordnet, die den Hauptwirkungsmechanismus des Pharmakons beschreibt (z. B. sorgen Analgetika dafür, Schmerzen im Körper zu bekämpfen – das ist ihre vornehmliche Wirkung). Allerdings heißt das nicht, dass Pharmaka einer Wirkstoffgruppe auch immer über den gleichen Mechanismus ihre Wirkung entfalten (z. B. gibt es unter den Analgetika viele verschiedene Varianten von Paracetamol über ASS bis hin zu den Nicht-steroidalen Antirheumatika oder Opioden, die sich wesentlich in der Art unterscheiden, in der sie Wirkung entfalten).
Unter Abschn. 8.1.4 finden sich die wichtigsten Wirkstoffgruppen, auf die Sie im Beruf stoßen können. Unter Abschn. 8.7 sind die dazugehörigen Medikamente aufgeführt.
Unerwünschte Wirkungen/Nebenwirkungen
Leider gibt es kaum ein Medikament, das ausschließlich nur die Wirkung entfaltet, für die man es hergestellt hat. Alle anderen Wirkungen, die neben der gewünschten auftreten, werden als „unerwünschte Arzneimittelwirkungen (UAW)“, „unerwünschte Wirkungen (UEW)“ oder schlicht „Nebenwirkungen (NW)“ bezeichnet. Hier kann man noch einmal differenzieren zwischen solchen NW, die mit der Dosis zusammenhängen (desto höher die Dosis, umso stärker die NW) und solchen, die dosisunabhängig auftreten. Von der Pharmaindustrie wird noch einmal eine Unterteilung in mehrere Stufen (von „sehr häufig“ bis „sehr selten“) vorgenommen.
Wechselwirkungen
Hierunter versteht man all jene Wirkungen, die auftreten können, wenn das entsprechende Medikament zusammen mit anderen Pharmaka, aber auch z. B. mit Alkohol, Koffein etc. eingenommen wird. Manchmal schwächen Medikamente gegenseitig ihre Wirkung ab (z. B. verhindert ein Antazida gegen Sodbrennen die vollständige Aufnahme anderer Medikamente) oder verstärken sie sogar.
Indikationen
Unter der Indikation (indicare = anzeigen) sind all jene Krankheiten/Symptome zusammengefasst, für die das entsprechende Medikament zur Anwendung kommt.
Kontraindikationen (KI)
Eine Kontraindikation stellt entsprechend den Ausschluss der Anwendung des therapeutischen Mittels, in diesem Fall des Medikaments, dar. Hier gibt es aber noch einmal folgende Unterscheidung:
Relative Kontraindikationen
Eine relative Kontraindikation spricht zunächst gegen die Maßnahme, in diesem Fall die Einnahme eines Medikamentes, lässt sie aber zu, wenn sie im konkreten Einzelfall voraussichtlich mehr nützt als schadet.
Absolute Kontraindikationen
Eine absolute Kontraindikation (manchmal auch als „Gegenanzeige“ bezeichnet) verbietet die Maßnahme, also die Einnahme des Medikamentes vollständig: Ein Patient, der einmal allergisch auf Penicillin reagiert hat, darf dieses Antibiotikum nicht mehr einnehmen, da eine erneute Einnahme lebensbedrohlich (anaphylaktischer Schock) werden könnte.
Indikationen und Kontraindikationen gibt es auch für jede radiologische oder nuklearmedizinische Untersuchung, insbesondere im Zusammenhang mit einer Kontrastmittelgabe.
Streng genommen existiert in der Radiologie nur eine echte absolute Kontraindikation: Implantate, die nicht für eine MR-Untersuchung zugelassen sind.
Alle anderen Kontraindikationen (auch eine KM-Unverträglichkeit) kann als relativ eingestuft werden.
Off-label-use
Als Off-label-use wird in Deutschland die „zulassungsüberschreitende Anwendung“ bezeichnet. Darunter versteht man, dass ein zugelassenes Fertigarzneimittel auch außerhalb des in der Zulassung beantragten und von den nationalen oder europäischen Zulassungsbehörden genehmigten Gebrauchs hinsichtlich der Anwendungsgebiete (Indikationen) und -arten, Dosierungen oder Patientengruppen eingesetzt werden darf. Ein Beispiel aus dem radiologischen Alltag: Triamcinolon ist ein synthetisches Glukokortikoid, das häufig in der CT-gesteuerten Schmerztherapie bei Wurzelreizsyndromen der Wirbelsäule verwendet wird. Ein anderes Beispiel ist Misoprostol. Es wird eigentlich eingesetzt, um medikamentenbedingte Magen- und Zwölffingerdarmgeschwüre zu behandeln (es hemmt die Magensäureproduktion). Da es aber auch die Kontraktion der Gebärmutter unterstützt, wird es im off-label-use auch in der Gynäkologie und Geburtshilfe eingesetzt.
8.1.4 Wichtige Wirkstoffgruppen im MTRA-Arbeitsalltag
Medikamente werden sog. Wirkstoffgruppen zugeordnet – also Gruppen, die Arzneimittel ähnlicher Struktur und Wirkungsweise zusammenfassen. Im Folgenden sind dabei exemplarisch Wirkstoffgruppen aufgeführt, denen Pharmaka angehören, die in der klinischen MTRA-Arbeit eine Rolle spielen.
Peptidhormone
Die meisten klassischen Hormone gehören zu der Gruppe der Peptidhormone (auch Proteohormone genannt), auch das Glucagon (Abschn. 8.7.1). Wichtige Eigenschaften dieser Gruppe sind:
Sie bestehen aus einer Proteinstruktur.
Sie sind wasserlöslich (hydrophil) und fettunlöslich (lipophob).
Aufgrund Ihrer Hydrophilität können sie Zellmembrane nicht ohne weiteres durchdringen und benötigen einen Rezeptor, um ihre Wirkung entfalten zu können. „Second messenger“ im Zellinneren vermitteln dann eine Umstellung des Stoffwechsels.
Sie werden sowohl vom Körper selbst als auch synthetisch zur therapeutischen Anwendung hergestellt (Beispiele hierfür sind Insuline oder Glucagon).
Parasympatholytika
Parasympatholytika werden auch als Anticholinergika oder Anti-Muscarin-Rezeptor bezeichnet, da sie die Wirkung von Acethylcholin (ACh) über eine Blockade des Muscarinrezeptors hemmen. Sie setzen sozusagen die Aktivität des Parasympathikus herunter und haben damit folgende Effekte:
Reduktion des Tonus der glatten Muskulatur des Magendarmtraktes, der ableitenden Harnwege und der Bronchialmuskulatur,
Erhöhung der Herzfrequenz,
Steigerung des peripheren Gefäßwiderstands,
Reduktion der Speichel-, Magensaft-, Bronchial- und Schweißsekretion,
Erweiterung der Pupille und Akkommodation des Auges auf die Ferne
Ein in der MTRA-Praxis gängiges Parasympatholytikum ist das Buscopan ® (Wirkstoff: Butylscopolamin , Abschn. 8.7.2), das häufig zur Relaxation der Darmmuskulatur verwendet wird, um Bewegungsunschärfen bei den Untersuchungen einzuschränken.
Anticholinerges Syndrom
Werden Anticholinergika überdosiert, kann es im Extremfall zum sog. anticholinergen Syndrom kommen, bei dem der Parasympathikus sozusagen komplett ausgeschaltet wird. Die Symptome, die dadurch auftreten, werden in periphere und zentrale Symptome unterteilt.Periphere Symptome
Obstipation
Harnverhalt
Tachykardie
Hypertonie
Mydriasis
Gerötete, trockene Haut
Verminderte Schweiß und Speichelsekretion
Zentrale Symptome
Verminderte Vigilanz
Aggressivität
Agitiertheit
Halluzinationen
Schwindel
Dysarthrie
Koma
Antiemetika (Dopamin-Antagonisten)
Antiemetika sind an sich keine eigene Wirkstoffgruppe, da zu viele unterschiedliche Substanzen eingesetzt werden, um gegen Übelkeit und Erbrechen zu helfen. U. a. zählen Dopamin-Antagonisten, wie das Paspertin ® (Wirkstoff: Metoclopramid , Abschn. 8.7.3), zu den Antiemetika. Dopamin-Antagonisten besetzen anstelle des Dopamins die unterschiedlichen Dopaminrezeptoren (D1–D4) und blockieren so die Wirkung des Dopamins.
Analgetika
Analgetika , zu denen auch das Nichtopiod-Analgetika Novalgin ® (Wirkstoff: Metamizol /syn. Novaminsulfon) Abschn. 8.7.4) ebenso wie das Opiodanalgetika Dipidolor (Wirkstoff: Piritramid , Abschn. 8.7.9) zählt, werden zur Schmerzlinderung, teilweise aber auch Fiebersenkung und Entzündungshemmung eingesetzt. Diese Wirkung entsteht über die Hemmung der Cyclooxygenase (daher auch COX-Hemmer) und infolge dessen der Blockade der Prostaglandin-Synthese.
Notfallmedikamente
Klassische Notfallmedikamente (Abschn. 8.6.3) gehören folgenden Wirkstoffgruppen an:
1.
Katecholamine: Sie wirken sowohl hormonell als auch als Neurotransmitter. Zu den wichtigsten Katecholaminen zählen Adrenalin, Isoprenalin, Noadrenalin, Dopamin und Dobutamin. Adrenalin bewirkt z. B. eine Steigerung der Herzfrequenz, einen Anstieg des Blutdrucks, eine Erweiterung der Bronchiolen, eine schnelle Bereitstellung von Energiereserven durch Fettabbau (Lipolyse) sowie die Freisetzung und Biosynthese von Glukose.
2.
Kortikosteroide : Hier sind vor allem die Glukokortikoide für den Notfalleinsatz wichtig. Sie sind Steroidhormone, die im Körper in der Nebenniere gebildet werden, aber teilweise auch als chemisches Pharmakon Anwendung finden. Cortisol und Cortison sind die bekanntesten Vertreter dieser Gruppe. Die wichtigste Wirkung dieser Gruppe ist ihre Fähigkeit der Entzündungshemmung.
3.
Antihistaminika : Sie wirken, wie der Name bereits vermuten lässt, an den Histaminrezeptoren (H1–H4) blockierend. H1-Antagonisten werden eingesetzt, um allergische Reaktionen (bei denen Histamin eine zentrale Rolle spielt) zu dämpfen, und kommen so auch beim allergischen Schock zum Einsatz.
4.
Benzodiazepine : Sie werden als Tranquilizer oder Neuroleptika eingesetzt. Neben ihrem angst- und krampflösenden Effekt wirken sie muskelentspannend und beruhigend, weswegen sie im Notfall (Status epilepticus Abschn. 8.6.3) ebenfalls zum Einsatz kommen.
β-Blocker
β-Blocker blockieren im Körper die β-Adrenorezeptoren und setzen so die Wirkung des Adrenalins und Noradrenalins herunter. Die Herzfrequenz und der Blutdruck werden gesenkt, daher finden β-Blocker wie das Metropolol (Abschn. 8.7.6) Anwendung bei erhöhtem Blutdruck oder der koronaren Herzkrankheit. Im Kardio-CT werden sie eingesetzt, um die Herzfrequenz während der Untersuchung zu verringern.
Katecholamine
Zu den Katecholamine n zählen Adrenalin, Noradrenalin und Dopamin (sog. natürliche Katecholamine, die im Körper vorkommen) und Isoprenalin, Dobutamin und Dopexamin (sog. synthetische Katecholamine). Sie fungieren als Neurotransmitter und Hormone. Dobutamin findet beim Stress-MRT Anwendung (Abschn. 8.7.8, Kap. 14).
Glykosaminoglykane
Glykosaminoglykane sind aus repetitiven Disaccharid-Einheiten bestehende Polysaccharide (also Mehrfachzucker), die ein wichtiger Bestandteil des Bindegewebes sind. Sie können Wasser binden und dienen als biologisches „Schmiermittel“. Einige Beispiele für Glykosaminoglykanen sind die Hyaluronsäure und das Heparin. Heparin wird auch therapeutisch eingesetzt, da es an verschiedene Antithrombinmoleküle bindet und in der Lage ist, bestimmte Gerinnungsfaktoren zu binden und ihre Wirkung zu verhindern. In der Angiographie wird Heparin zur Thromboseprophylaxe eingesetzt (Abschn. 8.7.10).
Heparininduzierte Thrombozytopenie (HIT)
Heparin kann zu einer Thrombozytopenie (einem Mangel an Thrombozyten, die für die Blutgerinnung, also Blutstillung wichtig sind) führen. Beim HIT I handelt es sich um eine leicht verlaufende Frühthrombozytopenie innerhalb der ersten 2 Behandlungstage.
Schwerwiegender verläuft die allergisch bedingte HIT II, die zu arteriellen und venösen Thrombosen führt. Diese tritt vor allem bei einer Behandlung länger als 5 Tage auf. Mit weniger als 1 % der behandelten Patienten ist diese bedrohliche Nebenwirkung selten. Bei diesen Patienten muss das Heparin durch Alternativen wie Argatroban ersetzt werden.
Schleifendiuretika
Schleifendiuretika sind harntreibende Medikamente (Diuretika), die die Urinproduktion erhöhen. Der größte Teil der Schleifendiuretika sind Sulfonamid-Derivate. Einige Beispiele sind Furosemid (Abschn. 8.7.11), Torasemid und Piretanid. Sie wirken über eine Hemmung des Na2ClK-Transporters an der Henle‘schen Schleife der Niere (daher auch „Schleifendiuretika“).
Schleifendiuretika vermehren zudem die Ausscheidung von Calcium und Magnesium.
Natriumkanalblocker
Natriumkanalblocker sind eine Gruppe von Arzneimitteln, die ihre Wirkung über die Blockung spannungsabhängiger oder nicht spannungsabhängiger Natriumkanäle entfalten. Zu den Natriumkanalblockern, die spannungsabhängige Kanäle blocken, zählt auch die Gruppe der lokal betäubenden Pharmaka (Lokalanästhetika), zu denen auch das Lidocain gehört (Abschn. 8.7.12), das u. a. auch in der Angiographie Einsatz findet.
8.2 Röntgenkontrastmittel
M. Kahl-Scholz5
(5)
Möhnesee, Deutschland
Kontrastmittel (KM) dienen in der Radiologie dazu, Gewebestrukturen besser hervorzuheben und damit beurteilbar zu machen. Da bestimmte Organe (z. B. die Bauchorgane) eine ähnliche Dichte aufweisen, wären sie ohne KM nur schwer in der Bildgebung unterscheidbar.
Ziel des Einsatzes von Röntgenkontrastmitteln ist es zudem, eine bessere Bildgebung bei gleichzeitig guter Verträglichkeit beim Patienten zu erreichen.
Eine gute Bildgebung ist abhängig von
einem hohen Kontrast,
einer detaillgenauen Darstellung,
einer von der Untersuchung abhängigen, lang genug anhaltenden Kontrastdarstellung.
Eine gute Verträglichkeit des Kontrastmittels bedeutet, dass das KM
keine physiologischen Vorgänge/Funktionen negativ beeinflusst,
die Blut-Hirn-Schranke oder Zellmembrane nicht durchdringt,
schnell und vollständig wieder ausgeschieden werden kann,
keine unerwünschten Nebenwirkungen zur Folge hat.
Das Enhancement , also die Anreicherung des KM in den Organen oder Geweben, ist vom jeweiligen Organ oder der jeweiligen Gewebsstruktur abhängig und lässt teilweise auf eine bestimmte Struktur im Körper rückschließen (z. B. beim Hämangion durch das sog. Rosettenphänomen, Abb. 8.3).
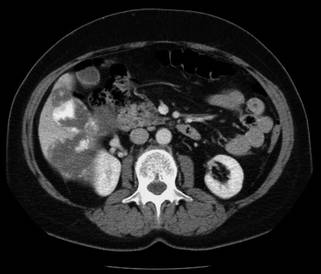
Abb. 8.3
Hämangiom der Leber mit Kontrastmittelenhancement. (© Vockelmann)
Aufgaben von Kontrastmitteln
Kontrastverstärkung in Geweben, die sich sonst wenig oder gar nicht in ihrer Dichte unterscheiden
Verbesserung der Beurteilbarkeit von funktionellen Abläufen (z. B. Blutfluss, Ausscheidung etc.)
8.2.1 Einteilung der Röntgen-KM
Kontrastmittel können die Absorption der Röntgenstrahlen vermindern (sog. negative Röntgenkontrastmittel), um sich vom umliegenden Gewebe abzugrenzen, oder erhöhen (sog. positive Röntgenkontrastmittel).
Röntgenkontrastmittel werden demnach in zwei große Hauptgruppen eingeteilt:
1.
Substanzen mit geringerer Dichte als die darzustellende Umgebung = negative Kontrastmittel (Gase, Wasser, Methyllcellulose, Sorbitol)
2.
Substanzen mit höherer Dichte als die darzustellende Umgebung = positive Kontrastmittel (Unterscheidung in wasserlöslich, wasserunlöslich und ölhaltig)
Negative Kontrastmittel
Zu den negativen Kontrastmitteln (Abb. 8.4), die in der Röntgendiagnostik Anwendung finden, zählen Gase, also Kohlenstoffdioxid (CO2), Stickstoffdioxid (NO2), Edelgas und schlicht: die Luft (z. B. zur Darstellung von Magen und Darm). Aber auch Wasser (bzw. auch Wasser-Mannitol-Lösungen), Methylcellulose, Paraffinsuspensionen und Sorbitol (Zuckeralkohol, Zuckerersatzstoff) zählen zu den negativen KM.
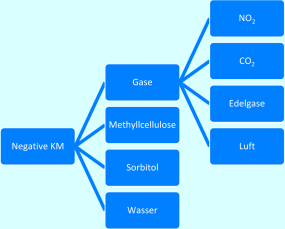
Abb. 8.4
Negative Kontrastmittel
Sorbitolunverträglichkeit sollte vor dem Einsatz von Sorbitol abgeklärt sein!
Nebenwirkungen von Mannitol können z. B. sein:
Störungen des Flüssigkeits- u. Elektrolythaushalts
Hypotonie
Allergische Reaktionen
Herzrhythmusstörungen
Schwindel
Kohlenstoffdioxid findet, ähnlich wie Methylcellulose, z. B. Anwendung in der Magen-Darm-Diagnostik, u. a. zur Doppelkontrastuntersuchung des Magens und zur Darstellung bei der virtuellen Koloskopie (Abb. 8.5a, b). Es wird im Darm allgemeinhin besser resorbiert als Raumluft und dadurch, wie Studien gezeigt haben, auch vom Patienten besser vertragen.
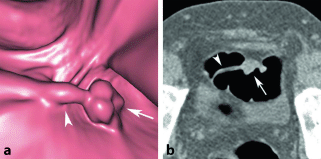
Abb. 8.5a,b
Virtuelle Kolonoskopie in 3D (a) und 2D (b) Rekonstruktion. Es zeigte sich ein gestielter Polyp (Pfeil). (Aus Mang et al. 2008)
CO2 kann übrigens auch in der intraarteriellen Angiographie von Nieren, der unteren Extremität und in der Diagnostik von Dialyseshunts als sehr nebenwirkungsarmes Kontrastmittel eingesetzt werden. Besonderen Nutzen haben dabei Patienten mit einer Unverträglichkeit auf iodhaltiges Kontrastmittel und Patienten mit einer Niereninsuffizienz. Nicht eingesetzt werden darf CO2 jedoch bei der Angiographie von Thorax, oberer Extremität oder supraaortal, da hierdurch schwerwiegende neurologische Komplikationen, im schlimmsten Fall begleitet von Schlaganfällen, ausgelöst werden können.
Doppelkontrast – was bedeutet das?
Unter Doppelkontrast versteht man die Durchführung einer Durchleuchtung mit einem positiven KM (meist Barium, Abschn. 8.2.1) und einem negativen KM (z. B. Cellulose, Wasser, CO2). Das negative KM sorgt für eine bessere Distension (Erweiterung, Aufweitung) des Darms und Verteilung des positiven KM, sodass ein besserer Kontrast der Darmfalten entsteht. Diese Technik (bekannteste Methode ist das Enteroklysma, also der Kontrasteinlauf nach Sellink) wird nicht mehr häufig durchgeführt, da andere bildgebende Methoden (vor allem die Kernspintomographie) mittlerweile bevorzugt zur gewünschten Darstellung eingesetzt werden.
Raumluft wird (teilweise ergänzend) zur Darstellung des Magens-Darm-Traktes (z. B. Kolondoppelkontrastuntersuchung) und bei Arthrographie n (kontrastmittelunterstützte radiologische Gelenkuntersuchung) eingesetzt.
Positive Kontrastmittel
Wasserlösliche, iodhaltige Kontrastmittel (Abb. 8.6)
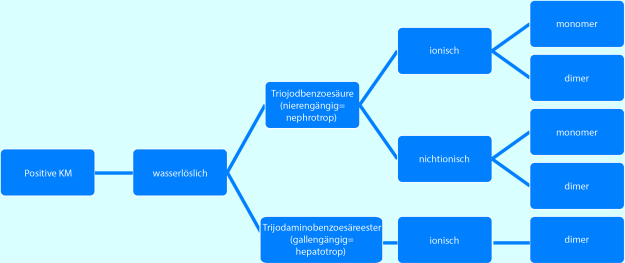
Abb. 8.6
Positive, wasserlösliche Kontrastmittel
Iodhaltige, wasserlösliche Kontrastmittel finden ihren Einsatz zur Darstellung von
Gefäßen (Angiographie, Phlebographie),
Nierenbeckenkelchsystem und ableitende Harnwege (z. b. MCU, Zystographie),
Gastrointestinaltrakt (oral),
Gallenwege (z. B. ERCP, PTCD).
Vor allem in der Computertomographie (speziell: CT-Angiographie, CT-Koronarangiographie) werden sie häufig verwendet. Auch bei der Myelographie kommen sie zum Einsatz.
Warum Iod?
Iodhaltige KM werden verwendet, weil Iod als chemisches Element eine hohe Kontrastdichte sowie eine relativ geringe Toxizität hat und eine feste Bindung mit den anderen chemischen Strukturen des Kontrastmittelkomplexes eingeht.
Triiodbenzosäure (nierengängig)
Hierbei handelt es sich um Kontrastmittel, die zum größten Teil durch glomeruläre Filtration über die Niere wieder ausgeschieden werden (daher nierengängig = nephrotop). Ein geringer Teil wird auch über das Leber-Galle-System und den Darm ausgeschieden.
Triiodbenzole erzeugen eine gut kontrastierte Darstellung und werden in ionische und nichtionische KM eingeteilt, wobei ionische KM keine praktische Anwendung mehr finden, da sie ein höheres Nebenwirkungspotential aufweisen (Tab. 8.1).
Tab. 8.1
Vergleich ionischer und nichtionischer Kontrastmittel*
Ionisch | Nichtionisch | |
|---|---|---|
Osmolatität | Hoch (daher auch „hochosmolare KM“; die Osmolalität bestimmt maßgeblich das Nebenwirkungsspektrum) | Niedrig (daher auch „niederosmolare KM“) |
Ladung | Elektrisch geladen | Nicht elektrisch geladen |
Löslichkeit | Nur als Salz ausreichend löslich (Megluminsalze > Natriumsalze) | Wasserlöslich durch hydrophile Seitenkettengruppen |
Proteinbindung | Ca. 10 % | Ca. 1,5 % |
Nebenwirkungen* | Gesamt: 12,66 % | Gesamt: 3,13 % |
Schwer: 0,22 % | Schwer: 0,04 % | |
Sehr schwer: 0,04 % | Sehr schwer: 0,004 % |
Triiodaminobenzoesäureester (lebergängig)
Kontrastmittel, die (durch Bindung an Leberzellen und Plasmaalbumin) über die Leber ausgeschieden werden, bezeichnet man auch als „hepatotrop“. Sie liegen ausschließlich in ionischer Form vor. Da die Leber nur eine bestimmte Menge verstoffwechseln und damit ausscheiden kann (0,35 mgJ/min/kg), muss die applizierte KM-Menge entsprechend angepasst werden.
Wird die Grenze überschritten oder ist die Leberfunktion eingeschränkt, wird das KM über die Niere ausgeschieden (Niereninsuffizienz)!
Bei einer pathologischen Einschränkung des Leberstoffwechsels sollte auf eine besonders schonende langsame Infusion geachtet werden.
Ionisch
Ionische Kontrastmittel tragen eine Salzgruppe in ihrer chemischen Struktur, die ihnen eine ionische Ladung gibt. Sie haben eine hohe Osmolalität (Anzahl an osmotisch wirksamen Teilchen in einer Lösung) und eine höhere Plasmaproteinbindung. Dadurch sind sie, im Gegensatz zu nichtionischen KM, auch weniger gut verträglich (Tab. 8.1). Das BfArM (Bundesinstitut für Arzneimittel und Medizinprodukte) erklärte 2000 zur i. v. Applikation bestimmter ionischer Kontrastmittel:
Ionische hochosmolale Kontrastmittel weisen eine höhere Chemotoxizität und eine höhere Osmotoxizität auf als die heute bevorzugt verwendeten niederosmolalen nichtionischen Kontrastmittel. Chemo-und Osmotoxizität bewirken eine Vielzahl unerwünschter Wirkungen an verschiedenen Organen beziehungsweise Organsystemen. Die intravasale Anwendung ionischer Kontrastmittel ist im Vergleich zur Anwendung nichtionischer monomerer Kontrastmittel mit einem signifikant höheren Risiko für die Auslösung einer Kontrastmittelnebenwirkung bei allen Patientengruppen verbunden.
Ionische KM finden, vor allem als i. v.-KM, kaum noch Anwendung in der Röntgen-Diagnostik (Tab. 8.2, Abb. 8.7) – die Verwendung sollte im Hinblick auf mögliche Risiken und vorbestehende Grunderkrankungen (Morbiditäten) der Patienten gut abgewogen werden.
Tab. 8.2
Einteilung gängiger Kontrastmittel in ionische und nichtionische KM
Ionisch | Nichtionisch |
|---|---|
Telebrix® (Ioxitalamat) | Hexabrix® (Ioxaglinat) |
Gastrografin® (i. d. R. oral/rektal) | Isovist® (Iotrolan) |
Peritrast® (i. d. R. oral/rektal) | Omnipaque® (Iohexol) |
Solutrast® (Iopamidol) | |
Ultravist® (Iopromid) |
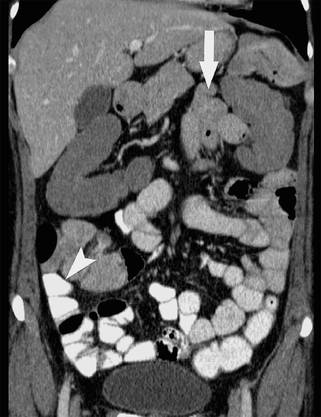
Abb. 8.7
Stärker kontrastiertes Colon (re.) nach rektaler Füllung mit verdünntem Kontrastmittel, oral gegebenes KM (Dünndarmschlingen) ist stärker verdünnt durch Flüssigkeitsretention im Darm bei Bridenileus im rechten Unterbauch. (© Vockelmann)
Nichtionisch
Nichtionische KM haben, wie die Bezeichnung vermuten lässt, keine ionisierende Gruppe, dafür aber eine hydrophile (also wasserliebende) Gruppe, die die Löslichkeit gewährleistet. Da sie eine geringere Osmolalität besitzen, als ionische KM (aber immer noch eine doppelt so hohe, wie die des Plasmas), werden sie auch als niederosmolare KM bezeichnet (Tab. 8.1). Aufgrund dieser Eigenschaft sind sie auch wesentlich seltener mit Nebenwirkungen assoziiert. Abb. 8.8 zeigt eine Darstellung der ableitenden Harnwege (Pyelogramm) mit einem nichtionischen KM.
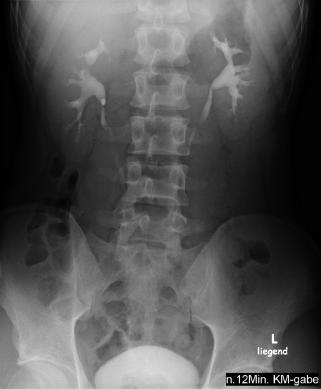
Abb. 8.8
Intravenöse Pyelogramm (IVP) 12 min nach KM-Gabe. (© Vockelmann)
Intravenöse iodhaltige Kontrastmittel werden renal eliminiert. Nur ein geringer Anteil wird hepatisch über die Galle ausgeschieden. Dieser Anteil kann dazu führen, dass Sie ein oder zwei Tage nach einer intravenösen Kontrastmittelgabe die Gallenblase kontrastiert sehen.
Monomere und Dimere
Sowohl bei den ionischen wie nichtionischen Kontrastmitteln gibt es monomere und dimere Varianten. Der Unterschied besteht in der chemischen Struktur: die Anzahl der Benzolringe bei dimeren nichtionischen KM beträgt zwei, bei monomeren nichtionischen KM nur eins – wegen der komplexeren Struktur sind dimere nichtionische KM auch visköser, also zähflüssiger und müssen deswegen vor Applikation angewärmt werden, da die Viskosität mit zunehmender Temperatur abnimmt.
KM sind vor ihrer Verwendung in einem Wärmeschrank, um die Viskosität zu verringern.
Durch die Viskosität können die KM nur mit erhöhtem Kraftaufwand gespritzt werden.
Bei KM-Pumpen können deswegen im kalten Zustand Fehler auftreten. Daher ist darauf zu achten, dass eine Wärmemanschette angewendet wird.
Dimere ionische Kontrastmittel besitzen hingegen z. B. zwei Säuregruppen.
Wasserunlösliche Kontrastmittel (Abb. 8.9)

Abb. 8.9
Positive, wasserunlösliche Kontrastmittel
Bariumsulfat
Bariumsulfat (BaSO4) wird in der Diagnostik des Magen-Darm-Traktes als oral verabreichtes KM eingesetzt (Abb. 8.10). Allerdings findet es heute nur noch in seltenen Fällen Anwendung.
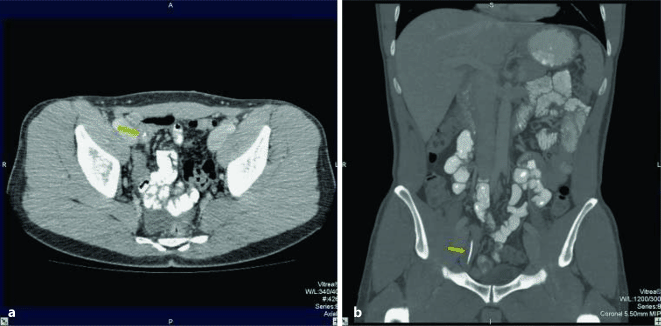
Abb. 8.10a,b
Koronare Rekonstruktion mit länglichem Fremdkörper im terminalen Ileum (Pfeil); im gewählten Knochenfenster hebt sich der Fremdkörper aufgrund seiner höheren Dichte besser vom verdünnten Bariumsulfat in den übrigen Darmschlingen ab. (Aus Fabel 2006)
Da Bariumsulfat sich hypoton zum Blutplasma verhält, kann es im Darm zum Wasserentzug führen.
Bei Verdacht auf Ileus (Darmverschluss), Perforation oder Nahtinsuffizienz, Schluckstörungen (Aspirationsgefahr!) oder weiteren schweren Erkrankungen darf es nicht eingesetzt werden.
Ölhaltige Kontrastmittel (Abb. 8.11)

Abb. 8.11
Positive, ölhaltige Kontrastmittel
Öle
Öle, die iodiert wurden, finden Anwendung in der Lymphographie. Allerdings sind sie im Körper nur schwer und unter Entstehung von Nebenprodukten abbaubar und so mit vielen Nachteilen bzw. Nebenwirkungen vergesellschaftet. Da im Lymphsystem wasserlösliche Kontrastmittel zu schnell diffundieren würden, und damit keine gute Darstellung der Lymphgefäße möglich ist, gibt es keine Alternative. Früher wurden iodierte Öle auch in der Myelographie eingesetzt (Abb. 8.12), die jedoch heute aufgrund der schweren Nebenwirkungen nur noch mit wasserlöslichen nichtionischen Kontrastmitteln durchgeführt wird.
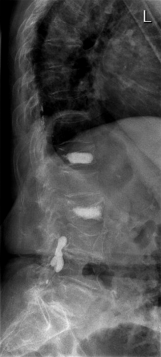
Abb. 8.12
Myeolographie mit ölhaltigem KM
Die zu verabreichende KM-Menge ist von der Untersuchung, dem Gewicht des Patienten und der Iodkonzentration des KM abhängig.
Stay updated, free articles. Join our Telegram channel

Full access? Get Clinical Tree