, Tina Hartmann1 und Ingrid Offenhäusser3
(1)
Schule für Gesundheitsberufe, Bereich MTRA, Klinikum Dortmund gGmbH, Dortmund, Deutschland
(2)
Praxis für Nuklearmedizin, Strassburger Allee 2-4, 45481 Mülheim, Deutschland
(3)
MTA Schule, Universitätsklinikum Aachen (AöR), Pauwelsstraße 30, 52074 Aachen, Deutschland
Bettina ist 43 Jahre alt und seit fünfzehn Jahren in der Nuklearmedizin tätig. Nach ihrer Ausbildung war sie ein paar Jahre in einer radiologischen Praxis, hat dann aber gewechselt, da sie keine Schichtdienste mehr machen wollte. Abgesehen davon hat ihr die Nuklearmedizin schon während der Ausbildung gut gefallen.
Sie empfindet die Arbeit in der Nuklearmedizin als sehr spannend und abwechslungsreich. Das liegt auch daran, dass in ihrer Abteilung nicht nur verschiedene diagnostische, sondern auch therapeutische Verfahren angewendet werden. Dadurch muss sie immer darauf achten, welches Nuklid an den Messgeräten gerade eingestellt ist oder wie sie sich im Umgang mit den Nukliden zu verhalten hat. „Betriebsblindheit“ kann so kaum entstehen.
Heute Vormittag ist sie in der Diagnostik eingeteilt, bereitet die Nuklide im Heißlabor vor und übernimmt zwei Untersuchungen an der Gammakamera.
Am Nachmittag hat Bettina Zeit für die wöchentlichen Konstanzprüfungen eingeplant und assistiert der Oberärztin bei den Radiosynoviorthesen.
10.1 Historische Entwicklung, Abbildungs- und Therapiemöglichkeiten
U. Blum4
(4)
Praxis für Nuklearmedizin, Strassburger Allee 2-4, 45481 Mülheim, Deutschland
Das Prinzip der Bilderstellung bzw. der Radioaktivitätsdetektion ist bei den Gammascannern, der Gammakamera und der Gammasonde gleich.
Bei den heute nicht mehr gebräuchlichen Scanner-Systemen wurde das zu untersuchende Organ zeilenweise abgetastet und eine Art Strichbild des Organs erstellt. Die Bilderstellung erfolgte häufig über einen direkt angeschlossenen Plotter.
Die Gammakamera löste die Scanner ab. Mit der Gammakamera werden alle Untersuchungen durchgeführt. Es gibt sie als spezielle Schilddüsenkamera, als Einkopf-, Zwei- und Drei-Kopfsysteme. Man unterscheidet außerdem zwischen planaren Gammakameras (nicht Kameraköpfe zur stationären Aufnahme einer Körperregion) und Kameras mit SPECT-Systemen (Rotation einer oder mehrerer Kameraköpfe um den Patienten).
10.1.1 Abbildungsmöglichkeiten
Szintillationszähler: Scanner, Gammakamera, Gammasonde
Gammasonden sind sehr kleine Meßgeräte, die insbesondere im Operationssaal zur Detektion von Wächterlymphknoten genutzt werden. Andere Einsatzmöglichkeiten sind die intraoperative Detektion der Nebenschilddrüsen. Hierbei wird die Strahlung in ein aktustisches Signal umgesetzt.
Die radioaktive Strahlung trifft auf einen Szintillationskristall (i. d. R. ein thalliumverstärkter Natrium-Iodid-Kristall). Im Kristall entsteht hierbei ein Lichtblitz, der auf eine Photokathode trifft. Es wird ein Elektron freigesetzt. Dieses wird nachfolgend durch einen Sekundärelektronenvervielfacher (SEV , bzw. Photomultiplier, PM ) verstärkt (Abb. 10.1). Von Dynode zu Dynode steigt die Spannung, sodass auf der Anode eine Vielzahl von Elektronen (Verstärkung ca. 105–109) auftrifft. Es erfolgt eine Verstärkung und Diskriminierung, mittels einer angeschlossenen EDV werden Bilder erzeugt. Um Streustrahlung weitgehend zu vermeiden, ist vor dem Kristall üblicherweise ein Kollimator angebracht.
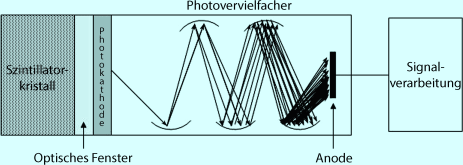
Abb. 10.1
Aufbau eines Szintillationszählers (SEV)
Dynode
Eine Dynode ist eine Elektrode aus einer Serie von Einzelelektroden.
Halbleiterkameras: aktuell nur als spezielle Kamera erhältlich (z. B. Herz, Brust)
Die Strahlung wird direkt vom Halbleiter (z. B. Kadmium-Zink-Tellurid) aufgefangen und in elektrische Ladung umgewandelt. Die Detektoren sind deutlich kleiner als bei einer „normalen“ Gammakamera, die Untersuchungszeiten können aufgrund der guten Energieauflösung deutlich reduziert werden.
Halbleiter
Ein Halbleiter ist ein Festkörper, der – je nach seinem Zustand – elektrisch leiten oder nicht.
PET
Wenn ein Positronenstrahl zerfällt, bildet sich ein positiv geladenes Antiteilchen (= Positron). Dieses trifft im Körper dann auf ein Elektron. Es entsteht die sog. Vernichtungsstrahlung; hierbei wird immer ein Paar γ-Quanten mit einer Energie von 511 keV gebildet (Abb. 10.2). Die γ-Quanten werden in einem Winkel von 180° zueinander ausgesendet. Nur wenn beide γ-Quanten auf den Detektionskristall treffen, werden diese als wahre Strahlung vom Gerät erkannt und als wahres Signal weiter verarbeitet. Dieses nahezu gleichzeitige Auftreffen der Strahlung wird als Koinzidenz bezeichnet. Aufgrund der verschiedenen weiteren Faktoren, wie das zeitliche Auftreffen der Strahlung und der örtlichen Registrierung der Strahlung, werden 3-dimensionale Schnittbilder erzeugt. Eine räumliche Zuordnung der Anreicherung ist manchmal schwierig, da sich nicht alle anatomischen Strukturen anhand ihres Stoffwechsels voneinander eindeutig unterscheiden.
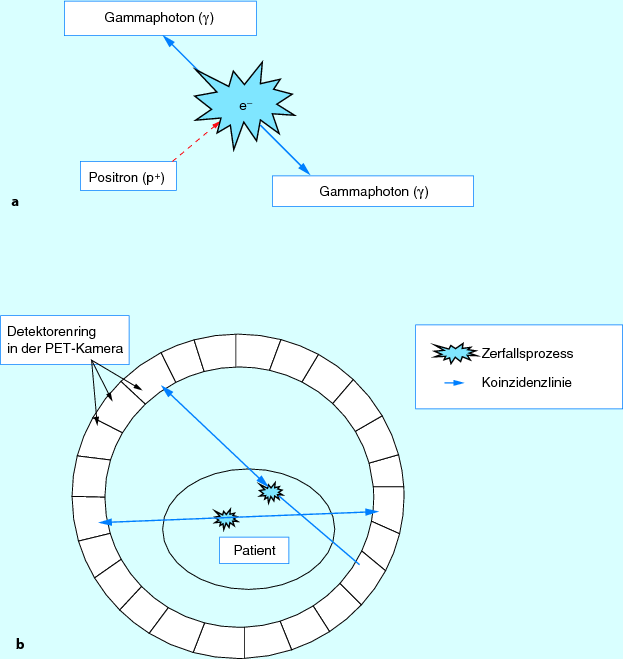
Abb. 10.2a,b
Vernichtungsstrahlung und Detektion der γ-Quanten im PET-Ringsystem
Ein PET-Gerät besteht normalerweise aus vielen kleinen Detektionskristallen (Wismutgermanat, BGO oder Lutetiumoxyorthosilicat, LSO), die ringförmig und hintereinander angeordnet sind. Mehrere Kristalle werden über einen SEV verstärkt.
Die Untersuchung erfolgt in 2D- oder 3D-Technik mit einer Schwächungskorrektur. 2D-Technik bedeutet, dass nur Koinzidenzen innerhalb einer Kollimatorreihe erkannt werden; in der 3D-Technik werden diese über alle Kollimatorreihen erkannt. Damit ist die 3D-Technik deutlich empfindlicher als die 2D-Technik, die 2D-Technik liefert dagegen sehr homogene Bilder.
Eine Schwächungskorrektur ist immer notwendig. Unterschiedliche Gewebe bewirken eine unterschiedliche Schwächung der durchtretenden Strahlung. Bei den reinen PET-Systemen erfolgt die Schwächungskorrektur über eine sog. Transmissionsmessung. Dabei wird eine externe Strahlenquelle (68 Gy Stabquelle) benutzt und eine Aufnahme gestartet. Das hierbei erstellte Tomogramm wird dann mit den Emissionsdaten der PET-Untersuchung überlagert. Dieses Verfahren muss für jede Bettposition durchgeführt werden und verlängert damit die Liegezeit des Patienten im Gerät erheblich. In den Hybrid-Geräten erfolgt die Schwächungskorrektur durch den CT- bzw. MRT-Datensatz.
Hybrid-Systeme
SPECT-CT, PET-CT, PET-MRT: Hierbei werden die nuklearmedizinischen Systeme mit dem jeweiligen radiologischen Gerät kombiniert. Die Kombination erlaubt damit eine sichere anatomische Zuordnung der Anreicherungen. Reine PET-Systeme sind selten geworden. Die Hybridgeräte können durch den radiologischen Datensatz immer eine Schwächungskorrektur der nuklearmedizinischen Daten bieten. Hierbei können alle Untersuchung durchgeführt werden. Die SPECT-CT erfolgt in der konventionellen nuklearmedizinischen Diagnostik (z. B. Herz, Hirn, Knochen), Die PET-CT bzw. PET-MRT überwiegend bei onkologischen Fragestellungen.
10.1.2 Therapiemöglichkeiten
Fast alle nuklearmedizinischen Therapien erfolgen aus Strahlenschutzgründen stationär. Ausnahme hiervon bilden die Radiosynoviorthese (Abschn. 10.1.2) und die palliative Schmerztherapie bei Knochenmetastasen (Abschn. 10.1.2).
Radioiodtherapie
Üblicherweise wird das radioaktive Iod (131I-NaI) in Kapselform eingenommen. Seltener kann es flüssig verabreicht oder intravenös gespritzt werden. Das radioaktive Iod verteilt sich gemäß dem normalen Iodstoffwechsel. Die Aufnahme erfolgt über den Magen-Darm-Trakt ins Blut, danach in die Schilddrüse. Hier wird es in das aktive Schilddrüsengewebe aufgenommen. Je nach Erkrankung werden unterschiedliche Dosen im Zielgewebe erreicht.
Bei bösartigen Erkrankungen der Schilddrüse kann die Radioiodtherapie zur Ausschaltung noch verbliebenen Restgewebes oder zur Therapie von Metastasen genutzt werden.
Der Patient wird mindestens 48 Stunden stationär aufgenommen werden. Der Entlassungszeitpunkt richtet sich nach der gesetzlich vorgeschriebenen Restaktivität im Körper. Ggf. sollte der Patient nach der Entlassung noch einige Strahlenschutzmaßnahmen einhalten (z. B. eingeschränkter Kontakt zu strahlenempfindlichen Personen, externe Radioaktivitätsmessungen), diese werden dem Patienten bei der Entlassung mitgeteilt.
Radiosynoviorthese (RSO)
Die RSO ist eine gezielte Behandlung einer chronischen Entzündung der Gelenkinnenhaut (Synovialitis). Für verschiedene Gelenke stehen unterschiedliche Substanzen zur Verfügung. Gesicherte Erfolge gibt es u. a. bei rheumatischen Gelenkerkrankungen und der Psoriasisarthritis (kann bei einer Schuppenflechte auftreten). Angewendet wird die RSO auch bei aktivierten Arthrosen oder bei Reizzuständen nach Implantation künstlicher Gelenke. Zum Einsatz kommen:
90Yttrium: Kniegelenk
186Rhenium: Schulter-, Ellbogen-, Hüft-, Hand- und Sprunggelenke
169Erbium: Finger- und Zehengelenke, Mittelhand- und Mittelfußgelenke
Die Applikation erfolgt streng intraartikulär unter Röntgenkontrolle (Ausnahme Kniegelenk). Eine falsche Injektion führt zu einer Gewebsnekrose des betroffenen Areals.
Das behandelte Gelenk sollte 48 h ruhig gestellt werden.
Palliative Schmerztherapie bei Knochenmetastasen
Skelettmetastasen, die in der Skelettszintigrafie anreichern, können mit verschiedenen radioaktiven Stoffen behandelt werden. Die Indikationsstellung erfolgt üblicherweise interdisziplinär mit allen behandelnden Ärzten und nach Ausschöpfung der konservativen Schmerztherapie.
Mögliche Stoffe zur Therapie sind die Strahler 89Strontium, 153Samarium, 186Rhenium, 188Rhenium und 32Phosphor. Alle Stoffe werden intravenös appliziert. Nach der Gabe sollte der Patient 2–3 Stunden überwacht werden. Es kann eine Szintigrafie nach der Gabe von Samarium oder Rhenium erfolgen.
Neu zugelassen (November 2013) wurde der α-Strahler 223Ra-Radiumdichlorid für die Behandlung von Knochenmetastasen bei Prostatakrebs. Auch dieses Präparat wird intravenös verabreicht.
Radioimmuntherapie
Bei der Radioimmuntherapie werden Antikörper (hier CD20-Oberflächenantigen) radioaktiv markiert. Zugelassen ist das 90Yttrium-markierte Ibritumomab-Tiuxetan (Zevalin®) zur Therapie von B-Zell-Lymphomen.
131I-MIBG (Meta-iodo-benzyl-guanidin)-Therapie
Spezielle Tumore können MIBG anreichern. Diese Tumore sind dann einer MIBG-Therapie zugänglich. Dazu zählen z. B. das maligne Phäochromozytom, das maligne Paragangliom, Karzinoide, das medulläre Schilddrüsenkarzinom sowie ein Neuroblastom im Stadium II oder IV.
Verschiedene Medikamente können die Aufnahme des MIBG stören und sollten daher entsprechend der Halbwertzeit ausgesetzt werden. Sowohl das Phäochromozytom als auch das Paragangliom können Katecholamine freisetzen, sodass diese Patienten u. U. eine Medikation mit α- und β-Blockern benötigen.
Die Therapie erfolgt über eine langsame intravenöse Infusion, hierbei sollten Blutdruck und Herzfrequenz kontrolliert werden.
Peptid-Therapie
Bei neuroendokrine Tumoren zeigt sich eine Vermehrung von Somatostatinrezeptoren. Diese Rezeptoren können genutzt werden, um neuroendokrine Tumore durch eine Szintigraphie nachzuweisen. Tumore, die eine entsprechende Anreicherung zeigen, sind einer Peptid-Therapie zugänglich. Hierbei kommen 90Yttrium-DOTATOC oder 177Lu-DOTATOC zur Anwendung.
Selektive interne Radiotherapie (SIRT)
Mit der SIRT können inoperable primäre Lebertumore oder inoperable Metastasen anderer Tumore therapiert werden. Hierbei werden kleine – mit 90Y markierte – Glas- oder Kunstharzpartikel intraarteriell in die Leber gespritzt. Die Mikrosphären haben einen Durchmesser von 20–30 µm (Glasmikrosphären) bzw. 20–60 µm (Harzmikrosphären).
Mikrosphären
Mikrosphären sind kleine, kugelförmige Molekülaggregate. In diesem Fall dienen sie dazu, sich nah am Tumor abzulagern und ihre Strahlung zur Karzinombekämpfung abzugeben.
Vor der Behandlung werden in einer selektiven Leberangiografie alle Gefäße verschlossen, die zu extrahepatischen Geweben führen (z. B. Magen, Darm), und es wird ein Verteilungsszintigramm mit 99mTc-MAA durchgeführt. Diese Szintigrafie dient dem Ausschluss extrahepatischer Anreicherungen sowie der Berechnung des Leber-Lungen-Shunts.
Leber-Lungen-Shunt
Hierunter versteht man Gefäßverbindungen zwischen Lunge und Leber, über die die Mikrosphären auch zur Lunge gelangen und dort Gewebe zerstören könnten.
Finden sich lediglich eine intrahepatische Anreicherung und ein nur geringer Lungenshunt, kann die eigentliche SIRT in einem nahen zeitlichen Abstand geplant werden.
In der SIRT ist auf die exakt gleiche Katheterlage wie in der MAA-Untersuchung zu achten.
Bei einer extrahepatischen Anreicherung der Mikrosphären kann es zu deutlichen Nebenwirkungen wie einer Strahlenpneumonitis oder einem Strahlenulkus kommen.
10.2 MTRA in der Nuklearmedizin mit speziellem Strahlenschutz
T. Hartmann5
(5)
Schule für Gesundheitsberufe, Bereich MTRA, Klinikum Dortmund gGmbH, Dortmund, Deutschland
Als MTRA in der Nuklearmedizin ist man nicht nur für die Bilderstellung der Szintigraphien zuständig, sondern auch für die Bereitstellung und Portionierung der benötigten Radiopharmaka.
Aus diesem Umgang mit offenen radioaktiven Stoffen ergeben sich für den persönlichen Strahlenschutz spezielle Anforderungen. Alle Bereiche, in denen man mit offenen radioaktiven Stoffen in Berührung kommen kann (d. h. auch radioaktive Körperflüssigkeiten der Patienten, z. B. Blut), finden im Kontrollbereich einer nuklearmedizinischen Abteilung statt, für den strenge Strahlenschutzvorschriften gelten.
So sind alle Tätigkeiten verboten, durch die man etwas leicht in den Körper aufnehmen, also inkorporieren kann. Dazu gehört insbesondere das Essen, Trinken, Rauchen oder Schminken.
10.2.1 Heißlabor
Im Heißlabor steht der Molybdän-Technetium-Generator, der arbeitstäglich eluiert werden muss. Außerdem werden dort die Radiopharmaka vorbereitet und die Spritzen portioniert.
Die Anforderungen an die technische Ausstattung eines Heißlabors sind in der DIN 6844 festgeschrieben. Die verwendeten Arbeitsmittel und -möbel müssen desinfizierbar und, im Fall einer Verschmutzung mit Radioaktivität, dekontaminierbar sein.
Bei der Arbeit im Heißlabor sind natürlich Handschuhe zu tragen und ein zusätzlicher Schutzkittel über die normale Dienstkleidung zu ziehen. Sollten ein paar Tropfen Radioaktivität auf Kittel oder Handschuh landen, kann man diese schnell ausziehen, bevor die Flüssigkeit auf Haut oder Unterkleidung gelangt.
Grundsätzlich sollten MTRA bei der Arbeit im Heißlabor zusätzliche Fingerringdosimeter tragen. Diese sind so zu positionieren, dass der Detektor im Handinneren getragen wird (wo die meiste Strahlung auftrifft) und nicht wie bei einem Schmuckstein zum Handrücken hin.
Beim Verlassen des Heißlabors muss man mind. seine Hände auf Kontaminationen prüfen. Dafür hängen z. B. Wanddetektoren am Ausgang.
Für die Arbeit im Heißlabor gelten grundsätzlich wieder die „3 A des Strahlenschutzes“:
Abstand: Bei jeder Tätigkeit sollte man möglichst viel Entfernung zwischen sich und die Strahlenquelle bringen.
Abschirmung: Wenn möglich sind radioaktive Stoffe mit Blei abzuschirmen.
Aufenthaltsdauer: Im Heißlabor muss sorgfältig und zügig gearbeitet werden, ein unnötiger Aufenthalt ist zu vermeiden.
Bleiburg
In der Nuklearmedizin versteht man unter der Bleiburg den direkten Vorbereitungsbereich der Radiopharmaka.
Eine Bleiburg besteht aus Bleibausteinen, die ggf. mit Edelstahl ummantelt sind, um ein Versickern von Flüssigkeiten in den Fugen zu verhindern. Die dicken Bleibausteine sind variabel kombinierbar und absorbieren die Strahlung sehr gut.
Bei der Verarbeitung der Radiopharmaka befinden sich nur die Hände und Unterarme der MTRA innerhalb der Burg, der Rest des Körpers wird abgeschirmt.
Um auch die empfindlichen Augenlinse vor Strahlung zu schützen, befindet sich zusätzlich ein Bauteil mit einer eingebauten Bleiglasscheibe an der Burg. Anfangs ist es etwas gewöhnungsbedürftig, in ungewöhnlichen Arm- und Handstellungen hinter einer Wand und unter einer Scheibe zu arbeiten, zumal zusätzlich Abstandshalter zu benutzen sind.
Abstandshalter
Gemäß dem Abstandsquadratgesetz nimmt die Dosis pro Fläche aufgrund der Divergenz der Strahlung mit dem Abstand zur Strahlenquelle ab. So erhält man nur noch ein Viertel der Dosis, wenn man den Abstand zur Strahlenquelle verdoppelt. Mit einem Abstandshalter (einer Art Zange für Medikamentenfläschchen) vergrößert man den Abstand von 0 cm (Fläschchen in der Hand) schnell um ein Vielfaches.
Auch hier muss man üben, um mit dieser „Handverlängerung“ sicher arbeiten zu können.
Spritzenabschirmung en
Jede aufgezogene Spritze ist in eine Abschirmung eingespannt. Bei Gammastrahlern (99mTc etc.) sind diese aus Blei bzw. Blei mit Edelstahl.
Bei Betastrahlern, wie sie z. B. für die Radiosynoviorthese eingesetzt werden, genügen ggf. schon Abschirmungen aus Plexiglas oder Plastik mit Bleieinlagerung.
Bei der Verwendung einer Spritzenabschirmung aus Plastik mit Bleiummantelung wird die Aktivität einer Spritze mit 90 Yttrium um den Faktor 1000 (in unmittelbarer Nähe zur Spritze) gesenkt.
Transporteinrichtungen
Zur Applikation des Radiopharmakons kommt der Patient selbstverständlich nicht in das Heißlabor. Die aufgezogenen Spritzen müssen also transportiert werden.
Um die Transportwege so gering wie möglich zu halten wurden in einigen Abteilungen die Applikationsräume direkt neben dem Heißlabor eingerichtet und durch eine Schleusenklappe miteinander verbunden. Die Schleuse ist ebenfalls wieder mit Blei abgeschirmt.
Für alle anderen Wege der Radiopharmaka innerhalb der Abteilung sind geeignete Transportbehälter aus Blei zu verwenden. Diese gibt es in verschiedenen Größen, je nachdem, ob man einen einzelne Spritze oder einen größeren Behälter (z. B. zur Abfallentsorgung) transportieren muss.
Abfallbehälter
In einem Heißlabor findet eine strikte Mülltrennung statt. Unterschieden wird zwischen kontaminiertem Abfall (inkl. solchem, bei dem eine Kontamination nicht sicher ausgeschlossen werden kann) und nicht-kontaminiertem Abfall.
Der kontaminierte Abfall wird in speziellen, bleiummantelten Behältern gesammelt und gelagert. Hier muss man aufpassen, dass nicht „aus Versehen“ etwas in diesem Abfall landet. In diesem Fall muss ein Mitarbeiter den gesamten „Müll durchwühlen“ und ist dabei einer hohen Strahlenbelastung ausgesetzt.
10.2.2 Gammakamera
An der Gammakamera ist, nach erfolgter Applikation des Radiopharmakons, der Patient die größte Strahlenquelle.
Natürlich darf man den Patienten während der Untersuchung nicht allein im Raum lassen.
Um sich als MTRA trotzdem vor einer unnötigen Strahlenbelastung zu schützen sollte auch hier der mögliche Abstand gewahrt werden. Man muss sich nicht direkt neben den Patienten und die Kamera setzen.
Darüber hinaus gibt es mobile Bleischutzwände, die wie ein Paravent im Raum bewegt werden können.
Beim Umgang mit Blutproben (z. B. bei Nierenszintigrafien) sind selbstredend wieder Handschuhe zu tragen.
Wird eine Lungenventilationsszintigraphie durchgeführt, besteht eine erhöhte Gefahr durch die radioaktiven Aerosole, die bei dieser Untersuchung zur Anwendung kommen. Aus diesem Grund sollten sich möglichst wenige Mitarbeiter im Raum befinden und darauf achten, keine Aerosole oder die Ausatemluft des Patienten („Para-Atmung “) selbst einzuatmen.
In einer nuklearmedizinischen Abteilung ist es zwingend erforderlich, dass alle Radiopharmaka gekennzeichnet und abgeschirmt (Bleiburg, Transportbehälter etc.) werden.
Auf jeder Spritze ist mindestens anzugeben, welches Nuklid sie enthält, und wann welche Aktivität aufgezogen wurde.
10.2.3 Verlassen der Abteilung
Bei jedem Verlassen des Kontrollbereiches müssen sich die Mitarbeiter „ausmessen“, also kontrollieren, ob sie frei von radioaktiven Kontaminationen sind. Dazu dient ein Kontaminationsmonitor am Ein- bzw. Ausgang des Kontrollbereiches. Dieser besitzt verschiedene Detektoren, um nicht nur die Hände, sondern auch Schuhe und Kleidung zu prüfen.
Die Ergebnisse der Messung sind zu dokumentieren und müssen sich innerhalb vorgegebener Toleranzgrenzen befinden. Anderenfalls darf man den Bereich nicht verlassen, sondern muss sich auf die Suche nach der Ursache der Kontamination machen, ggf. die Kleidung zum Abklingen verwahren und duschen.
Wenn man als MTRA die notwendigen Strahlenschutzmaßnahmen beachtet und umsetzt, beträgt die berufliche Strahlenexposition pro Jahr ca. 1–3 mSv.
10.3 Detektion von Radioaktivität
I. Offenhäusser6
(6)
MTA Schule, Universitätsklinikum Aachen (AöR), Pauwelsstraße 30, 52074 Aachen, Deutschland
Nach Strahlenschutzbelehrung wird Schülerin Jelena im Heißlabor mit dem Aufziehen und der Markierung radioaktiver Substanzen vertraut gemacht. Sie darf zum ersten Mal Aufziehen, die Hände sind zittrig. Geübt hat sie mit Wasser lang genug, dennoch macht sie der Umgang mit Technetium ein wenig nervös. Jelena hat die Haare zusammengebunden, mag aber keine Hosen, die in Knöchelhöhe abschließen. Nach einem doch anstrengenden Praktikumstag stellt sie sich auf den Hand-Fuß-Monitor, der ihr signalisiert, dass sie kontaminiert ist. Sie schaut hinter sich, ob im Flur ein Patient sitzt oder eine Kollegin mit einer Aktivitätsspritze vorbeiläuft. Nichts dergleichen. Sie zieht den Kittel aus, es piept, sie zieht die Schuhe aus, es piept; und da kommt auch noch die Lehrkraft um die Ecke.
Hat sie nicht erst gestern etwas von Hosen erzählt, die in keinem Fall über den Boden schleifen dürfen?
Was ist zu tun?
10.3.1 Grundlagen
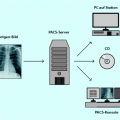
Die in der nuklearmedizinischen Diagnostik und Therapie verwendeten radioaktiven Substanzen werden mithilfe unterschiedlicher Detektoren registriert. Zur in vivo (im lebenden Organismus) und in vitro (im Reagenzglas) Messung von Gammastrahlung werden geeignete Detektoren eingesetzt, die die von Photonen ausgelösten Wechselwirkungsprozesse (Photoeffekt, Comptoneffekt und Paarbildung) in Materie nachweisen können. Die im Detektor entstandene Absorption wird in einen elektronischen Impuls umgewandelt. Dieser wird nur dann weitergeleitet, wenn er der Energie des zu messenden Nuklides entspricht. Die Registrierung der weitergeleiteten Ereignisse erfolgt über Zählgeräte oder Computersysteme. Die registrierte Zählrate ist proportional zur vom Strahler ausgegangenen Aktivität.
Ein wesentliches Unterscheidungsmerkmal der Detektoren zum Nachweis von Gammastrahlung ist das im Detektor verwendete Material.
10.3.2 Szintillationsdetektoren
Ein Medium hoher Ordnungszahl Na/OZ 53, wird im sog. Szintillationsdetektor genutzt. Szintillationsdetektoren geben die beim Durchgang von Photonen oder Elektronen entstehende Anregungsenergie in Form von Licht ab. Ein solcher Szintillationsdetektor ist das Kernstück der Gammakamera, die die Verteilung einer applizierten Aktivität im Patienten aufzeichnet (Abschn. 10.4.1).
Sondenmessplatz
Ein einfacher in der in-vivo Diagnostik benutzter Szintillationsdetektor ist der sogenannte Sondenmessplatz . Der enthaltene NaJ-Kristall ist hier nur mit einem einzelnen, relativ großen, Kollimator ausgestattet (Abschn. 10.4.1). Dieser hat die Aufgabe, den Detektor vor Umgebungsstrahlung zu schützen. Ein Sondenmessplatz wird zur Bestimmung der prozentualen Aktivitätsaufnahme (Up-Take) eines applizierten Radiopharmakons zu unterschiedlichen Zeitpunkten benutzt. Die Up-Take-Messung ist z. B. für die Planung einer Radioiodtherapie von besonderer Bedeutung.
Gammasonde
Besonders klein ist der Szintillationsdetektor der Gammasonde mit 10–20 mm, der von einem Bleikollimator umgeben ist. Die Gammasonde wird zur prä- bzw. intraoperatven Auffindung des Sentinel-Lymphknotens verwendet (Abschn. 21.4, Abb. 10.3). Dieser kann mithilfe eines akustischen Signals bzw. einer optischen Anzeige detektiert werden.
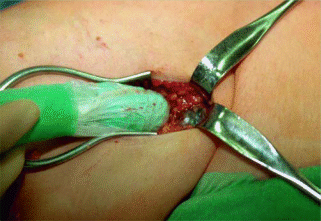
Abb. 10.3
Gammasonde intraoperativ
Bohrlochmessplatz
Ein weiterer Szintillationsdetektor befindet sich im sog. Bohrlochmessplatz , der zum Nachweis geringer Aktivitäten eingesetzt wird. So können Allergene oder Hormonspiegel über Antigen- oder Antikörper-Reaktionen (IRMA/RIA) im Patientenserum oder -urin über die Messung radioaktiver Verbindungsanteile bestimmt werden. Da es sich um sehr geringe Aktivitätsmengen handelt, muss auch hier ein Detektormaterial hoher Ordnungszahl (NaJ/OZ 53) eingesetzt werden, das U-förmig die Probe umschließt. Das Probelvolumen muss so gewählt werden, dass es komplett in der zentralen Bohrung versenkt werden kann, sodass alle ausgehenden Quanten den Detektor erreichen. Er ist zum Schutz gegen Umgebungsstrahlung mit Blei ummantelt. Patientenproben können einzeln und mit der Hand oder über einen Probenwechsler automatisch zugeführt werden. Auch gibt es Messplätze, die mehrere einzelne NaJ Bohrlochdetektoren besitzen, sodass eine gleichzeitige Messung mehrerer Proben möglich ist (Abb. 10.4). Diese werden über ein Kunststoff-Rack in die korrekte Messposition gebracht. Allerdings können nur Tracer niederer Energie gemessen werden, da bei hoher Energie Impulse der Nachbarprobe einfließen.

Abb. 10.4
Bohrlochmessplatz
Qualitätskontrolle Bohrlochmessplatz
Das Energiefenster wird mit einem langlebigen Prüfstrahler z. B. 137Cs eingestellt. Der Nulleffekt ist täglich durchzuführen, denn bei der geringen Aktivität der zu messenden Probe kann eine kleine Verunreinigung der Bohrung die Messergebnisse extrem verändern. Bei Plätzen, die mit Racks oder Ketteneinsätzen befüllt werden, müssen diese in die Nulleffektmessung mit einbezogen werden. Zur Bestimmung der Ausbeute wird ein 137Cs-Prüfstrahler bekannter Aktivität verglichen mit der angezeigten Aktivität. Die Funktion des Zählers und des Zeitgebers eines Messplatzes wird mit einem internen oder externen Impulsgenerator überprüft. Zur Konstanzprüfung der Nuklidtasten misst man zwei Radionuklide unterschiedlicher Energie in manueller Einstellung und ein weiteres Mal unter Einsatz der Festtasten. Der Quotient beider Messungen wird gebildet und mit dem Referenzwert verglichen, der bei 1 liegt.
Flüssigszintillator en
Niederenergetische Betateilchen können wegen ihrer geringen Reichweite Festkörperszintillatoren nicht erreichen. Sie werden mithilfe flüssiger, organischer Szintillatoren nachgewiesen (z. B. 3H, 14C, 90Sr). Der gelöste Szintillator wandelt die entstandenen Elektronen in Licht um. Sie werden von zwei PMP gemessen.
Gasionisationsdetektoren
Als Medium niederer Ordnungszahl wird ein in einer Kammer befindliches Gas (Luft, Edelgase wie He, Ar, Kr, Xe) eingesetzt. Wird eine solche Gasionisationskammer von einem Gammastrahler getroffen, so werden aus den Gasmolekülen Elektronen gelöst, das Gas wird ionisiert. Es verbleibt ein positiv geladenes Gasmolekül auf der einen Seite und ein freies Elektron auf der anderen Seite. Diese Ladungsträger werden bei angelegter Hochspannung zur negativ geladenen Kathode bzw. zur positiv geladenen Anode transportiert. Es fließt ein Strom, der gemessen werden kann. Abhängig von der angelegten Hochspannung definiert sich der Arbeitsbereich der Ionisationskammer. Im sog. Rekombinationsbereich entgehen die Ladungsträger der Messung, da sich negative und positive Teilchen wieder verbinden. Im sich spannungsmäßig an den Rekombinationsbereich anschließenden Sättigungsbereich ist die angelegte Hochspannung so hoch, dass keine Rekombinationen mehr stattfinden können, jeder Ladungsträger wird registriert. In diesem Bereich arbeiten Ionisationskammern. Bei weiterer Hochspannungserhöhung werden die primär erzeugten Elektronen so stark beschleunigt, dass sie weitere Atome ionisieren. Es entsteht eine Elektronenlawine, die proportional zum Primärereignis ist (Arbeitsbereich der Proportionalitätszählrohre). Wird die Hochspannung weiter in den sog. Auslösebereich gesteigert, kann ein einziges Primärelektron zur Ionisation des gesamten Kammervolumens führen, was beim Nachweis kleinster Aktivitätsmengen im Strahlenschutz von Bedeutung ist (Abb. 10.5).
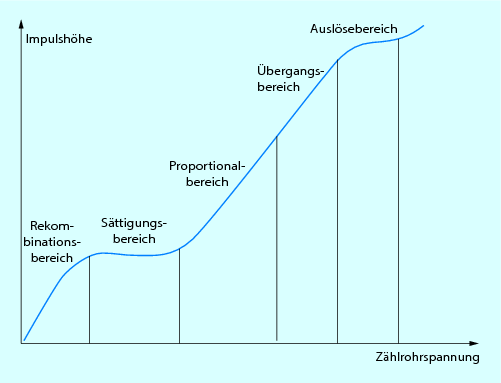
Abb. 10.5
Impulshöhencharakteristik einer Ionisationskammer
Aktivimeter
Eine Ionisationskammer ist als zylinderförmiger Schacht der Grundbaustein des sog. Aktivimeters. In dieses wird mithilfe eines Probenhalters die Aktivitätsprobe oder -spritze eingesetzt, sodass immer die gleiche Messgeometrie gegeben und die Kammer vor Kontamination geschützt ist. Die die Schachtionisationskammer umgebende Bleiabschirmung von 3–16 mm Dicke, schützt diese vor Untergrundstrahlung, die zur Verfälschung des Messergebnisses führen würde (Abb. 10.6). Über Nuklidtasten, hinter denen sich gespeicherte Isotopenfaktoren verbergen, sind die verschiedenen Energiefenster bequem anwählbar. Das Ansprechvermögen des Aktivimeters liegt in einem Messbereich bis 200 GBq und in einem Energiebereich von 35 KeV bis 3 MeV sehr weit.
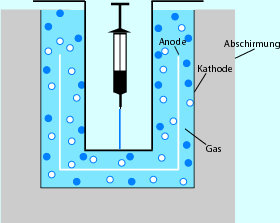
Abb. 10.6
Aufbau eines Aktivimeter s
Qualitätskontrolle des Aktivimeters
Die Proportionalität zwischen der Anzeige und den unterschiedlichen Aktivitäten muss gegeben sein. Sie unterliegt der arbeitstäglichen Prüfung. Die Abweichung darf nicht größer als 5 % sein und wird mit einem Prüfstrahler, der 3,7 MBq 137Cs enthält, überwacht. Verglichen wird die Anzeige des Aktivimeters mit der tatsächlichen Aktivität des Prüfstrahlers. Die tägliche Kontrolle der Zählrate ohne Probenaktivität (Nulleffekt) soll eine Kontamination des Messgerätes und des Probenhalters ausschließen. Die halbjährlich notwendige Prüfung der Systemlinearität wird über den radioaktiven Zerfall einer Probe eines kurzlebigen Radionuklids (z. B. 99mTc) bestimmt. Dabei werden Aktivitäten zwischen 1 MBq und 60 % der maximal zu messenden Aktivität (z. B. Generatoreluat) verwendet. Es werden zwei Messwerte je HWZ bestimmt, die Abweichung darf auch hier maximal 5 % von dem durch Zerfall errechneten Aktivitätswert betragen (DIN 6855 Teil 11). Bei Prüfung der Nuklidtasten wird der EKA von Hand auf den gleichen Energiebereich (z. B. 141 KeV / 99mTc) eingestellt wie er über die Festtaste eingegeben wurde. In beiden Einstellungen müssen die Impulsraten der gemessenen Probe übereinstimmen.
Die Herstellerkallibrierung des Aktivimeters muss alle 6 Jahre wiederholt werden.
10.3.3 Messsysteme im Strahlenschutz
Jeder im Überwachungs- oder Kontrollbereich arbeitende Mitarbeiter ist laut StrlSchV verpflichtet, die Personendosis an einer repräsentativen Stelle der Körperoberfläche äquivalent zu bestimmen.
Personendosimeter
Die Überwachung der Strahlenbelastung kann z. B. durch ein Filmdosimeter erfolgen, wenn mit Photonen-, Elektronen- oder Neutronenstrahlung umgegangen wird. Ein solches Dosimeter (Abb. 10.7) besteht aus einer zweiteiligen Gleitschattenkassette, die Absorber unterschiedlicher Ordnungszahl enthält (z. B. Aluminium, Kupfer, Blei). Die Absorber auf Vorder- und Rückseite sind unterschiedlich geformt und versetzt angeordnet, sodass bei Auswertung der Schwärzung der innenliegenden Filme unterschiedlicher Empfindlichkeit festgestellt werden kann, aus welcher Richtung die Strahleneinwirkung stattgefunden hat. Durch die unterschiedliche Dichte der Absorber kann bei Durchtritt von Strahlung deren Energie bestimmt werden. Die Auswertung des an der Vorderseite des Rumpfes getragenen Personendosimeters erfolgt durch die zuständige zentrale Personendosimetriestelle einmal monatlich.

Abb. 10.7
Filmdosimeter
Ringdosimeter
Ein weiteres in der nuklearmedizinischen Routine verwendetes Dosimeter ist das Ringdosimeter, das die Strahlenbelastung der Hand ermittelt und im Heißlabor eingesetzt wird (Abb. 10.8). Der Ring enthält einen Thermo-Lumineszenz-Detektor, eine Substanz (z. B. Calciumfluorid verunreinigt mit Mangan), die die absorbierte Strahlungsenergie speichert. Der Kristall wird durch eine entsprechende Auswertstelle einmal monatlich erhitzt. Dadurch wird die gespeicherte Energie in Form von sichtbarem Licht abgegeben. Der Ring wird zusätzlich zum Filmdosimeter eingesetzt.

Abb. 10.8
Ringdosimeter
Elektronische Dosimeter
Elektronische Dosimeter sind sofort ablesbar und deshalb besonders zur Überwachung schwangerer Frauen geeignet, die im Überwachungsbereich tätig sind. Sie zeigen die gemessenen Werte digital an (Abb. 10.9




Stay updated, free articles. Join our Telegram channel

Full access? Get Clinical Tree