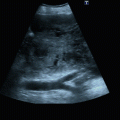
Abb. 9.1
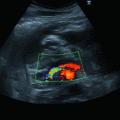
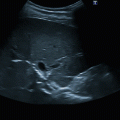
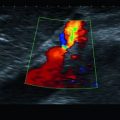
Perikarderguss: a parasternale lange Achse, b parasternale kurze Achse
Beurteilung in allen Anlotpositionen, da auch lokalisierte Ergüsse vorkommen, insbesondere allerdings im Subkostalschnitt (◘ Abb. 9.1).
Lokalisation: lokaler, gekammerter oder zirkulärer Perikarderguss.
Abklärung einer Perikardverdickung/‑schwiele/‑verkalkung, dann ggf. angrenzende regionale LV‑ oder RV‑Wandbewegungsstörung.
Differenzialdiagnosen des Perikardergusses: peri‑/epikardiales Fett, Zyste, Aszites, linksseitiger Pleuraerguss.
Echokardiographische Beurteilung der hämodynamischen Relevanz:
Bei zirkulären Ergüssen als erstes (zunächst diastolische) Kompression des rechten Atriums, dann Kompression des rechten Ventrikels (Cave: Lokalisierte Ergüsse können auch lokalisierte Beeinträchtigungen verursachen, z. B. von LA/LV).
Atemvariabilität des transmitralen und ‑trikuspidalen Einstroms im PW‑Doppler (transmitral inspiratorische Abnahme der E‑Wellen‑Geschwindigkeit >25 %, transtrikuspidal exspiratorische Abnahme der E‑Wellengeschwindigkeit >40 %), „konstriktives“ Einstromprofil (E>>A, kurze DT, E/lat. e’>12, ▶ Abschn. 6.1.2).
Dilatation der V. cava inferior mit verminderter bis fehlender atemabhängiger Kaliberschwankung.
Echokardiographie der konstriktiven Perikarditis
Die Untersuchung umfasst (◘ Abb. 9.2):

Abb. 9.2
Kardiale Amyloidose , parasternale lange Achse
Beurteilung der Atemvariabilität des ventrikulären Einstroms und „konstriktives“ Einstromprofil und Beurteilung der V. cava inferior wie oben.
Suche nach Perikardverdickungen, ‑verkalkungen und ggf. sekundären angrenzenden „regionalen WBST“.
Typischerweise ist die Geschwindigkeit des medialen e’ größer als die des lateralen e’ (physiologisch umgekehrt), e’ >8 cm/s.
Differenzialdiagnostische Charakteristika der Restriktion im Gegensatz zur konstriktiven Perikarditis:
Keine Atemvariabilität des ventrikulären Einstroms.
e’<8 cm/s.
Dilatation in der Regel beider Vorhöfe.
(Biventrikuläre) ausgeprägte Myokardhypertrophie, ggf. typisches echokardiographisches Bild einer Amyloidose (◘ Abb. 9.2).
Meist Nachweis einer pulmonalen Hypertonie.
Kein Nachweis von Perikardverdickungen. Ein in der Regel kleiner Perikarderguss ist allerdings typisch für die Amyloidose.
9.2 Endokarditis
Guido Michels, Henrik ten Freyhaus, Roman Pfister
Die infektiöse Endokarditis besitzt eine hohe Letalität, die sich je nach Erreger deutlich unterscheidet: durchschnittlich ca. 20 % (jedoch 40 % bei einer Staphylokokken-Endokarditis und 50 % bei einer Pilzendokarditis), sodass eine umgehende Abklärung bereits bei begründetem Verdacht in die Wege geleitet werden muss. Hier sind in erster Linie die gründliche körperliche Untersuchung, die repetitive Abnahme von Blutkulturen und die Echokardiographie zu nennen. Weiterhin sollte nach potentiellen Embolien gefahndet werden (klinische Untersuchung inklusive Neurologie und Sonographie des Abdomens).
Duke-Kriterien der infektiösen Endokarditis
2 Hauptkriterien:
Positive Blutkultur
Nachweis endokarditistypischer Erreger in 2 unabhängigen Blutkulturen:
Viridans-Streptokokken, Streptococcus bovis, HACEK‑Gruppe (folgende gram‑negative Stäbchen werden darunter zusammengefasst: Haemophilus aphrophilus/Aggregatibacter aphrophilus, Aggregatibacter actinomycetemcomitans, Cardiobacterium hominis, Eikenella corrodens, Kingella kingae), Staphylococcus aureus oder
ambulant erworbene Enterokokken bei Abwesenheit eines Primärfokus.
Mikroorganismen vereinbar mit einer infektiösen Endokarditis in persistierend positiven Blutkulturen:
mindestens 2 positive Blutkulturen aus Blutentnahmen mit mindestens 12 Stunden Abstand oder
jede von 3 oder eine Mehrzahl von ≥4 separaten Blutkulturen (erste und letzte Probe in mindestens 1 h Abstand).
Eine einzelne positive Blutkultur mit Coxiella burnetii oder Phase‑I‑IgG-Antikörper-Titer >1:800.
Echokardiographischer Nachweis der Endokardbeteiligung
6 Nebenkriterien:
Prädisposition: prädisponierende Herzerkrankung oder i.v.‑Drogenabusus,
Stay updated, free articles. Join our Telegram channel

Full access? Get Clinical Tree