, Claudia Marks2 und Julia Thiele3
(1)
Christiansgasse 14, 8750 Glarus, Schweiz
(2)
Klinik für Radioonkologie, Universitätsklinikum Tübingen, Hoppe-Seyler-Str. 3, 72076 Tübingen, Deutschland
(3)
Klinik für Strahlentherapie und Radioonkologie, Universitätsklinikum Carl Gustav Carus an der Technischen Universität Dresden, Fetscherstr. 74, 01307 Dresden, Deutschland
Am Freitagnachmittag erhält der diensthabende Strahlentherapeut eine Konsilanforderung über eine 65jährige Patientin, die kurz zuvor in die Notaufnahme eingeliefert wurde. Sie hat seit mehreren Tagen „Pudding” in beiden Beinen, d. h. die Beine sind gefühllos und versagen ihr. Inzwischen kann sie aus eigener Kraft weder stehen noch laufen. Der Strahlentherapeut entnimmt der digitalen Krankenakte der Patientin, dass sie bereits vor 8 Jahren, nach Diagnose eines Mammakarzinoms, an der rechten Brust bestrahlt worden ist. Eine aktuelle Bildgebung (Ganzkörper-CT) zur Ausbreitungsdiagnostik wurde bereits von den Ärzten der Notaufnahme veranlasst und zeigt eine Raumforderung in der Lendenwirbelsäule, die den Wirbelkanal sichtbar einengt und bereits in mehrere Wirbelkörper eingewachsen ist.
?
1. Was könnten die neurologischen Ausfälle der Patientin ausgelöst haben?
2.
Welche Behandlungsoptionen werden die Ärzte anhand des radiologischen und neurologischen Befundes in Erwägung ziehen?
3.
Welche Fraktionierungsschemata könnte der Strahlentherapeut verordnen?
4.
Wie wird die notfallmäßige Bestrahlung der betroffenen Bereiche in der Wirbelsäule geplant?
5.
Welche Wirkung hat die Bestrahlung auf die Raumforderung in der Wirbelsäule?
6.
Welche Rolle spielen die MTRA im Falle einer notfallmäßigen Bestrahlung? Was sind ihre Aufgabenbereiche?
9.1 Historische Entwicklung
J. Thiele4
(4)
Klinik für Strahlentherapie und Radioonkologie, Universitätsklinikum Carl Gustav Carus an der Technischen Universität Dresden, Fetscherstr. 74, 01307 Dresden, Deutschland
Die Strahlentherapie hat von dem technischen Fortschritt der letzten 30 Jahre und von den Ergebnissen klinischer Studien auf hohem Niveau sehr profitiert. Durch die Nutzung des CT, MRT und PET in der Bestrahlungsplanung kann die Tumorvernichtung gezielter erfolgen und das gesunde Gewebe noch besser geschont werden. Die Nebenwirkungen und Rezidivraten haben sich erheblich reduziert. Durch den enormen technischen Wandel konnten neue Bestrahlungskonzepte und Techniken, wie z. B. die Intensitätsmodulierte Radiotherapie (IMRT), Tomotherapie oder Stereotaxie, entwickelt und in den klinischen Alltag implementiert werden. Es war ein langer Weg mit vielen innovativen Ideen, die die Behandlung von Tumorerkrankungen ermöglichten und verbesserten.
9.1.1 Die „Neue Art von Strahlen“ und deren Nebenwirkung
Schon 1896 wurden die ersten Röntgenapparate gebaut und in Betrieb genommen. Sehr schnell merkte man, dass die Röntgenstrahlen erfolgreich bei Tumoren und Gelenkbeschwerden angewandt werden können. Allerdings fehlten die Erfahrungen im Umgang mit der neuen Technologie, vor allem Ärzte und das Assistenzpersonal erlitten Hautentzündungen, weil sie aus Unwissenheit ihre Hände im Strahlengang hielten.
Später folgte die Erkenntnis, dass diese Röntgenstrahlen Sterilität und Krebs verursachen können, zudem wurden Veränderungen im Blut und in den blutbildenden Organen beobachtet. Erst Mitte der 1920er Jahre des letzten Jahrhunderts wurde der Einfluss der Röntgenstrahlen auf das Erbgut und die genetischen Veränderungen von dem amerikanischen Genetiker Herman J. Muller (1890–1967) beschrieben.
Die konventionelle Röntgentherapie
Die guten Ergebnisse in der Tumorbehandlung mittels Röntgenstrahlen inspirierten zur Weiterentwicklung der Röntgenröhre. Die Strahlung sollte aufgehärtet werden, dies gelang Georg Perthes (1905) mithilfe von Aluminiumfiltern. Später wurde mit der Konstruktion aus Glühkathode und Antikathode aus Wolfram eine größere, gleichmäßigere und reproduzierbare Strahlenausbeute erreicht. Mitte der 1920er wurden erstmals mit einem definierten Fokus-Haut-Abstand (20 cm) und dem Einsatz von Aluminium- oder 0,5 mm Kupferfilter erste Mehrfeldtechniken am Becken angewendet (Gauss 1956). Diese Form der Applikation brachte einen besseren Strahlenschutz und eine höhere Sicherheit – sowohl für den Patienten als auch für den Anwender.
9.1.2 Die Entdeckung der Radioaktivität
Ein weiterer Meilenstein war die Entdeckung der natürlichen Radioaktivität durch Henri Becquerel 1896 und 1898 durch Marie Curie anhand von Uran und später Radium. Man erkannte, dass der Gammastrahlenanteil des Radiums tiefer in das Gewebe eindringt als Röntgenstrahlung. Nun konnte therapiert werden, indem man für kurze Zeit das radioaktive Material sehr nahe an den Tumor brachte. Anfang des letzten Jahrhunderts kam das Radium-226 vorzugsweise in der Gynäkologie zur Anwendung. So wurde beispielsweise 1949 eine „Kleinraumbestrahlung“ (nah = griechisch: Brachy) zur Behandlung von gynäkologischen Tumoren mit Radium-226 an der Universität Göttingen vorgestellt. Sie gilt als Vorläufer des heutigen Afterloading. Hier wurde das Radium gelagert in Applikatoren in die Körperhöhle gebracht, ebenfalls konnten der radioaktive Stoff in Moulagen (Abschn. 9.3) eingebettet und auf die Körperoberfläche gelegt werden. Durch die Angaben der Lieferanten zur Aktivität konnte die Dosierung in „mg-Element-Stunden“ mit der Liegezeit in Stunden berechnet werden. Das Radium wurde in den 1960er Jahren durch andere Nuklide ersetzt, da sich aufgrund seines Zerfalls in Radon-222 große Nachteile für den Strahlenschutz der Patienten und des Personals ergaben. In Deutschland setzte sich das Radionuklid Iridium-192 durch. Das Bestrahlungsgerät befindet sich nun im Bestrahlungsraum und die Steuereinheit in einem Schaltraum außerhalb des Bestrahlungsraumes.
Um Tumore auch in tieferen, nicht direkt zugänglichen Regionen schonend zu behandeln, wurde nach weiteren Möglichkeiten der Strahlenapplikation gesucht. Die Lösung hierfür fand sich in der Entwicklung und Einführung der Teletherapie Anfang der 1950er Jahre.
9.1.3 Die Telekobalttherapie
Ab Mitte der 1950er Jahre kam das Kobaltgerät als Teletherapie zum Einsatz. Die ersten Anwendungen gab es in Kanada. Nun war es möglich, mit dem radioaktiven Kobalt-60 tiefliegende Tumore mit ausreichender Dosis und guten Dosisverteilungen zu bestrahlen. Telekobaltgeräte gelten als unkompliziert und nahezu störungsfrei. Nachteilig ist jedoch die Halbschattenzone, zwischen bestrahltem und nicht bestrahltem Gebiet, da die Quelle eine größere Ausdehnung als der Fokus eines Röntgengerätes hat. Durch den flachen Halbschatten wurde unter Umständen mehr Dosis im gesunden Gewebe appliziert. Zudem stellen auch die niedrige Dosisleistung und die Notwendigkeit eines Quellenwechsels alle 3–5 Jahre einen Nachteil dar (zum Beispiel einer Kobaltkanone s. Abb. 9.1).

Abb. 9.1
Kobalt-Kanone. (http://www.spiegel.de/spiegel/print/d-42621051.html „Kobalt-Kanone“ 51/1958)
9.1.4 Der Linearbeschleuniger
Der Linearbeschleuniger (engl. linear accelerator, kurz: Linac) löste in den 1970er Jahren das ebenfalls weit verbreitete Hochvoltgerät Betatron ab. Das Betatron, ein Kreisbeschleuniger, brachte wenig biologische Vorteile und war aufgrund der Größe des Bestrahlungsgerätes und Handhabung eher nachteilig für die Behandlung von Tumorpatienten.
Die Idee von der Entwicklung des Linearbeschleunigers gab es schon Mitte der 1920er Jahre, amerikanischen Wissenschaftlern gelang es mit einer relativ geringen Wechselspannung, Teilchen zu beschleunigen. Erst Mitte der 1940er Jahre wurden in Amerika größere Wanderwellenbeschleuniger entwickelt. Die Linearbeschleuniger gelten als technisch stabil und können sowohl mit Photonen als auch mit Elektronen bestrahlen.
Heute ist der Linac das wichtigste Therapiegerät in der Strahlentherapie. Aus einem Injektor werden Elektronen in einem hochfrequenten elektrischen Feld beschleunigt. Diese Elektronen können direkt verwendet oder durch ein Target abgebremst werden, wodurch ultraharte Röntgenstrahlung (Photonen) entsteht (Abschn. 9.3).
Bedeutend für die Arbeit am Linac ist die Entwicklung des Mulitleaf-Kollimators (MLC). Dieser löste Mitte der 1990er Jahre die feldspezifische und individuell gegossene Blende als Feldformung ab. Die Weiterentwicklung des MLC durch Bewegung während der Bestrahlung (Abschn. 9.3), ist seit Mitte des letzten Jahrzehntes Basis für die Einführung der intensitäts-modulierten Radiotherapie (IMRT, Abschn. 9.3) oder der Applikation kleinvolumiger stereotaktischen Bestrahlungsfelder via Mikro-MLC. Dieser enorme technische Fortschritt ermöglicht uns heute eine hochpräzise, für das gesunde Gewebe weitgehend schonende Strahlentherapie und ist Standard in jeder Strahlenklinik.
Moderne Bildgebung
Mit der Entwicklung elektronischer Bildgebungssysteme (electronic portal imaging device: EPID) Anfang der 1990er Jahre, wurden der Portfilm als Felddokumentation schrittweise abgelöst und durch Flachbilddetektoren, die am Linac eingebaut sind, ersetzt.
Image Guided Radiotherapy (IGRT) oder bildgeführte Strahlentherapie gewinnt immer mehr an Bedeutung in der Strahlentherapie. Moderne Verifikationssysteme ermöglichen die Positionsbestimmung des Zielvolumens mithilfe von 2D- und 3D Techniken. In vielen Kliniken ist die CT-gestützte Strahlentherapie und der Einsatz von Goldmarkern (z. B. Prostata) für eine präzise Lokalisation des Bestrahlungsgebietes ebenfalls Standard.
Die Anwender können von der Einführung komplexer onkologischer Informationssysteme der führenden Hersteller profitieren. Anfänglich wurden die Bestrahlungsdaten per Hand aufgeschrieben, später dann durch Magnetkarten ersetzt. Heute werden diese Daten größtenteils im onkologischen Informationssystem gespeichert und zusätzlich auf Papier (Einzeldosis, Einverständnis und Verordnung) dokumentiert. Der Trend geht allerdings zur papierlosen digitalen Patientenakte.
9.1.5 Die Geschichte der Bestrahlungsplanung
Die Einführung der Mehrfelder-Bestrahlungstechniken und die gewonnenen Erkenntnisse zur Strahlenbiologie in den 20er Jahren des letzten Jahrhunderts veranlasste die Anwender, Konzepte zur Fraktionierung und Dosisverteilung auszuarbeiten und in die Röntgentherapie zu implementieren. Mit der Gründung der ICRU (International Commission on Radiation Units and Measurement) im Jahr 1925, wurden erstmals internationale Einheiten zur Messung der Strahlung am Menschen festgelegt. Heute werden die Empfehlungen des ICRU Komitees international angewandt und regelmäßig aktualisiert.
Die Planung der Bestrahlung erfolgte ab Mitte der 1930er Jahre zweidimensional, Herr Hans Holfelder (1891–1944) veröffentlichte in diesen Jahren seine Idee zur Dosisverteilung. Die von ihm konstruierten Felder wurden mit durchsichtigen Schablonen aufgezeichnet, damit konnten Tiefendosiskurven (Abschn. 9.3) auf einen errechneten Körperdurchschnitt aufgelegt und berechnet werden.
Die zweidimensionale Therapieplanung wurde in den 1980er Jahren durch die Einführung der Computertomographie in der Strahlentherapie durch eine dreidimensionale Planung schrittweise ersetzt. Die Bilddaten und virtuellen Dichtewerte des Gewebes (Hounsfield Unit kurz: HU) im Planungs-CT bilden heute die Basis für eine individuelle Therapieplanung (Abschn. 9.6). Spezielle Planungsprogramme ermöglichen, unter Berücksichtigung der spezifischen Anatomie, die Erstellung eines virtuellen Bestrahlungsplanes. Die interdisziplinäre Zusammenarbeit zwischen Ärzten, Medizinphysikexperten, MTRA, Pflegepersonal und Informatikern dient seit vielen Jahren als Basis für eine sehr gute Qualität der Behandlung von Tumorpatienten.
9.2 MTRA in der Strahlentherapie mit speziellem Strahlenschutz
C. Marks5
(5)
Klinik für Radioonkologie, Universitätsklinikum Tübingen, Hoppe-Seyler-Str. 3, 72076 Tübingen, Deutschland
9.2.1 Aufgaben der MTRA in der Strahlentherapie
Während der Strahlentherapie haben die MTRA den engsten Patientenkontakt und sind über mehrere Wochen für die Patienten direkter Ansprechpartner und Bezugsperson.
Zu den wichtigsten Aufgaben gehören:
Bestrahlungsplanung
Durchführung der Bestrahlung
Patientenbetreuung (vor, während und nach der täglichen Bestrahlung)
Organisationsaufgaben
Bestrahlungsplanung
Die Tätigkeiten der MTRA in der Bestrahlungsplanung können unterschiedliche Arbeitsbereiche umfassen. Dieser Arbeitsplatz setzt einige Erfahrung als MTRA in der Strahlentherapie voraus: bezüglich der optimalen Lagerung, zusätzlichen Hilfsmitteln etc. Es werden die ersten Termine für die CT-Planung und die Ersteinstellung vereinbart, im CT werden in enger Zusammenarbeit mit den Ärzten individuelle Lagerungshilfen angefertigt und Schnittbilder erstellt.
Detaillierte Informationen finden Sie in diesem Buch im Abschn. 9.6 „Bestrahlungsplanung“ und in „Strahlentherapie und Onkologie“ (Sauer 2003).
Durchführung der Bestrahlung
Die Durchführung der täglichen Bestrahlung ist der Hauptaufgabenbereich der MTRA in der Strahlentherapie.
Vor der Ersteinstellung
Die Patientenakte wird auf Vollständigkeit überprüft: Einverständnis und Bestrahlungsverordnung müssen unterschrieben sein. Die MTRA macht sich mit der Patientenakte, eventuellen Besonderheiten (wie z. B. bekannte Klaustrophobie des Patienten, zusätzliche Hilfsmittel für die Lagerung) und dem Bestrahlungsplan vertraut, u. a. mit der Bestrahlungstechnik, der Anzahl der Felder und der Lagerung des Patienten. Die Lagerung mit sämtlichen Lagerungsmitteln, wie angefertigte Bestrahlungsmasken oder Lagerungskissen, wird vorbereitet.
Die MTRA vergewissert sich vor Beginn der Behandlung über die korrekte Identität des Patienten und erläutert den weiteren Ablauf der ersten Bestrahlung. Der Patient wird auf dem Bestrahlungstisch gelagert und auf das Isozentrum (Abschn. 9.3.5) eingestellt.
Alle weiteren Schritte sind unter Abschn. 9.6.9 „Erste Bestrahlung“ ausführlich erläutert.
Tägliche Bestrahlung
Der Patient kommt i. d. R. über einen Zeitraum von mehreren Wochen an den Werktagen zur Bestrahlung. In dieser Zeit lernt man als MTRA den Patienten näher kennen. Die Identitätsprüfung zu Beginn einer jeden Behandlung stellt somit künftig kein Problem dar.
Ist einem der Patient unbekannt, ist die Identitätsprüfung nach dem Aufrufen des Patienten im Wartebereich die erste und wichtigste Handlung: Steht der richtige Patient bereit und wurde der richtige Bestrahlungsplan (richtiges Isozentrum) am Computer aufgerufen?
Eine mögliche Verwechslung des Patienten und die Bestrahlung der falschen Bestrahlungsfelder muss unter allen Umständen ausgeschlossen werden. Vergewissern Sie sich selbst vor Beginn der Bestrahlung, ob alles korrekt eingestellt wurde. Auch wenn Sie im Stress sind, rechtfertigt das eine unachtsame oder nachlässige Arbeitsweise nicht!
Die Lagerung des Patienten erfolgt wie bei der Ersteinstellung. Falls nötig, können vorab Verifikationsaufnahmen angefertigt und die Lagerung korrigiert werden (Abschn. 9.6.9). Bei korrekter Position des Patienten wird die Bestrahlung durchgeführt. Der Patient wird dabei die ganze Zeit über Videokameras überwacht, um im Notfall (z. B. Unruhe des Patienten bei starken Schmerzen, plötzlicher Luftnot, Wadenkrampf, Hustenanfall) die Behandlung sofort unterbrechen zu können.
Patientenbetreuung
Neben der erforderlichen technischen Begabung zur MTRA, benötigen wir in unserem Beruf ebenso ein hohes Einfühlungsvermögen. Die Patienten kommen anfangs angespannt zur Bestrahlung. Sie haben viele Fragen und Sorgen und sind froh und dankbar für ein „offenes Ohr“. Dabei erwarten sie i. d. R. keine Musterantwort auf ihr Anliegen, sondern sind einfach nur dankbar, jemanden zum Reden zu haben.
Die tägliche Routine erleichtert es dem Patienten, ihre Anspannung und die Angst vor der Behandlung im Lauf der Therapie zu verlieren. Manche Patienten mit Schmerzen oder Behinderungen, benötigen eventuell Hilfe beim An- und Ausziehen oder beim Positionieren. Patienten, die zu Klaustrophobie neigen, benötigen Ihre Fürsprache, auch während des Bestrahlungsvorgangs.
Viele MTRA, aber auch Auszubildende, tun sich schwer im Umgang mit krebskranken Menschen und wissen oft nicht, wie sie sich ihnen gegenüber verhalten sollen. Sie haben Angst etwas Falsches zu sagen oder sich falsch zu verhalten. Man weiß, dass sie krank sind und möchte sie nicht noch durch ein Gespräch darauf hinweisen. Aber man muss ja nicht über die Erkrankung selber reden, viele Patienten wollen das auch gar nicht. Oft ergeben sich Gespräche mit dem Patienten von ganz alleine, bei der täglichen Begegnung, beim Lagern und Einstellen. Im Laufe der Zeit, wenn man schon viele Patienten behandelt hat, merkt man recht schnell mit welchem Patienten man es zu tun hat. Ist er ängstlich und verschlossen und möchte durch ein Gespräch eher abgelenkt werden? Ist er offen und neugierig und fragt Sie regelrecht über alles Mögliche aus? Oder ist er umgänglich und macht auch mal einen Scherz?
Haben Sie keine Bedenken, wenn ein Patient Sie in ein längeres Gespräch verwickelt und schon der Nächste wartet. Hin und wieder sollte man sich auch im eng terminierten Arbeitsablauf die Zeit nehmen, mit einem Patienten zu sprechen, vor allem wenn dieser einen Rat braucht. Durch die zunehmende Anzahl an Patienten pro Tag, die bestrahlt werden müssen, gleicht die tägliche Arbeit oft einer „Fließbandarbeit“ – wir haben es aber in erster Linie mit Menschen zu tun und einen sozialen Beruf ergriffen!
Organisation
Eine anspruchsvolle Aufgabe ist das Zeitmanagement am Bestrahlungsgerät. Sämtliche Termine aller Patienten müssen aufeinander abgestimmt und nach Möglichkeit auch ihre „Wunschzeiten“ berücksichtigt werden. Darüber hinaus haben viele Patienten weitere Behandlungstermine, die sie wahrnehmen müssen. Diese können in anderen Praxen oder Kliniken stattfinden, aber auch in der Abteilung selber, wie Hyperthermie oder Chemotherapie. Für den Handlungsablauf am Gerät ist es aus Zeit- und Praktikabilitätsgründen am günstigsten, Behandlungen mit identischer Lagerung (z. B. Mamma-Board) in kontinuierlicher Reihenfolge durchzuführen. Das alles miteinander in Einklang zu bringen, erfordert Vorausschau und Organisationstalent.
Während der wöchentlichen Qualitätskontrollen und der jährlichen Wartungsarbeiten kann das Bestrahlungsgerät für den Patientenbetrieb vorübergehend nicht benutzt werden. Dann ist es erforderlich, dass die Bestrahlungen an anderen Geräten fortgesetzt werden. Davon sind nicht nur die Termine der Patienten betroffen, meist bedeutet das auch für die MTRA eine Umorganisation der Arbeitszeiten. Manchmal ist eine Bestrahlungspause wegen der Geräteüberprüfung nicht zu verhindern. Der Arzt wird in diesem Fall entscheiden, wie der Ausfall der Therapie kompensiert wird (Abschn. 9.5, Hyperfraktionierung).
Tritt ein unerwartetes technisches Problem im laufenden Betrieb auf, kann es einige Zeit dauern, bis die Störung behoben werden kann. Häufig reagieren Patienten bei längeren Wartezeiten ungehalten und fragen sich, was los ist. Informieren Sie darum umgehend die Patienten im Wartebereich. Die Patienten werden Ihnen für die rasche Mitteilung dankbar sein. Sie fühlen sich dadurch eingebunden und haben eher Verständnis, länger warten zu müssen.
Informationen über die Radioonkologie und aktuelle Fortbildungsangebote und Stellenangebote für MTRA in der Strahlentherapie auf der Internetseite der Deutschen Gesellschaft für Radioonkologie e. V. unter www.degro.de
9.2.2 Strahlenschutz in der Strahlentherapie
Vorschriften
Die Vorschriften für den Aufbau und die Arbeit in einer strahlentherapeutischen Einrichtung sind in der Strahlenschutzverordnung (StrSchV) geregelt.
Die MTRA, die Radioonkologen und auch die MPEs (Medizinphysikexperten) müssen nach § 30 StrSchV für den Umgang mit ionisierender Strahlung über die entsprechende Fachkunde verfügen und diese mindestens alle 5 Jahre erneuern bzw. aktualisieren. Zusätzlich muss jährlich an einer Strahlenschutzunterweisung teilgenommen werden.
Strahlenschutz für den Patienten
Für die Bestrahlung eines Patienten mit ionisierender Strahlung muss durch eine rechtfertigende Indikation von einem fachkundigen Arzt gestellt werden. Er ist dazu verpflichtet abzuwägen, ob alternative Behandlungsmethoden ein gleiches oder sogar besseres Ergebnis liefern würden.
Bleischürzen oder andere in der diagnostischen Radiologie verwendeten Strahlenschutzmaßnahmen finden in der Strahlentherapie keine Verwendung. Die hochenergetische Strahlung erzeugt beim Auftreffen auf das Material, durch den Comptoneffekt, zusätzliche Streustrahlung in Form von Photonen und Elektronen.
Der Radioonkologe erstellt zusammen mit dem MPE einen individuellen Bestrahlungsplan. Dabei wird darauf geachtet, eine ausreichend hohe und homogene Dosis am Tumor zu erzielen, das gesunde Gewebe dabei aber möglichst wenig zu belasten, um die Nebenwirkungen der Radiotherapie auf ein Minimum zu reduzieren.
Die individuell angepasste Lagerung kann ebenfalls zum Strahlenschutz beitragen. Die Bauchlage auf dem Lochbrett, in dessen Aussparung der Bauch bzw. die Dünndarmschlingen gelagert werden, kann bei Beckenbestrahlungen zur Vermeidung von Durchfall und Bauchkrämpfen beitragen. Hodenkapseln schützen die Gonaden und erhalten die männliche Zeugungsfähigkeit.
Feldkontrollaufnahmen dienen einerseits zur Überprüfung der Lagerung und Gewährleistung der präzisen Radiotherapie, stellen aber auch eine zusätzliche Strahlenbelastung dar und sollten nur im Bedarfsfall täglich durchgeführt werden.
Bei der Lagerungskontrolle mithilfe des Cone-Beam-CT (X-Ray Volume Imaging Device, Abschn. 9.3.2) können nicht nur Knochenstrukturen, sondern auch Organe wie die Prostata oder die Blase sichtbar gemacht werden, aber auch Risikostrukturen wie das Myelon. Dadurch ist die Lagerungskorrektur noch genauer, allerdings ist die Strahlenbelastung für den Patienten nicht zu vernachlässigen. Für ein CT als Feldkontrolle im Beckenbereich kann sich eine zusätzliche Dosis von bis zu 30 mGy, bei Kopf-/Hals-CTs zwischen 0,6 und 1,2 mGy pro Untersuchung ergeben.
Strahlenschutzbereiche in der Strahlentherapie
Die in § 36 StrSchV festgelegten Strahlenschutzbereiche sind für die Strahlentherapie wie folgt geregelt:
Überwachungsbereich
Im Überwachungsbereich innerhalb der Strahlentherapieabteilung können Personen eine effektive Dosis (= Körperdosis) von > 1 mSv/a oder eine Organdosis von > 15 mSv auf die Augenlinsen oder von > 50 mSv auf die Haut oder die Extremitäten erhalten.
Hierzu gehören der Wartebereich, die Flure der Abteilung und die Bereiche um die Beschleunigerbunker.
Zugang haben nach § 37 StrSchV nur Personal, das dort beschäftigt ist, Patienten und deren Angehörige oder Besucher und Auszubildende oder Studenten.
Kontrollbereich
Im Kontrollbereich können Personen eine effektive Dosis (= Körperdosis) von > 6 mSv/a oder eine Organdosis von > 45 mSv auf die Augenlinsen oder von > 150 mSv auf die Haut oder die Extremitäten erhalten.
Dazu gehört der Beschleunigerbunker, da sich hier bei hohen Strahlungsenergien zusätzlich Radioaktivität entwickeln kann. Ab 8 MeV können Materialien (Luft, Bunkerwände, Teile des Linearbeschleunigers) Neutronen einfangen und selbst strahlen (aber mit geringer Halbwertszeit). Auch der Bestrahlungsraum für die Brachytherapie gehört zum Kontrollbereich, sofern die Strahlenquelle nicht ausgefahren ist.
Dieser Bereich muss durch ein Warnschild mit der Aufschrift „KONTROLLBEREICH“ deutlich gekennzeichnet werden. Er darf nur von dort arbeitendem Personal betreten werden oder als Patient, Angehöriger oder als helfende Person. Auszubildende oder Studenten dürfen sich dort nur aufhalten, wenn es für die Ausbildung zwingend nötig ist. Hier ist von jeder Person, außer dem Patienten, zur Überwachung der Körperdosis ein Personendosimeter zu tragen. Zusätzlich müssen diese Personen, wie das Personal, eine Unterweisung über die entsprechenden Strahlenschutzmaßnahmen erhalten.
Schwangere Frauen dürfen sich nur nach Zustimmung der Strahlenschutzverantwortlichen dort aufhalten und müssen mit zusätzlichen Überwachungsmaßnahmen ausgestattet werden.
Sperrbereich
Der Kontrollbereich wandelt sich in dem Moment, in dem bestrahlt wird, in den Sperrbereich. Hier beträgt die Ortsdosisleistung mehr als 3 mSv pro Stunde, die Kennzeichnung mit einem Warnschild „SPERRBEREICH – KEIN ZUTRITT“ ist Pflicht. Es dürfen sich nur Personen dort aufhalten, wenn es für ihre berufliche Ausübung unumgänglich ist und sie der Kontrolle des Strahlenschutzverantwortlichen unterstehen oder als Patient, der dort behandelt werden muss. Auch hier ist das Tragen eines Personendosimeters zwingend erforderlich.
Schwangere Frauen dürfen diesen Bereich unter keinen Umständen betreten, außer sie sind selbst Patientin und müssen sich aus medizinischen Gründen einer Bestrahlung unterziehen.
Zu den Sperrbereichen der Strahlentherapie gehören der Bestrahlungsraum für die Brachytherapie, wenn die Strahlenquelle ausgefahren ist und der Beschleunigerbunker, allerdings nur so lange das Bestrahlungsgerät strahlt. Für die Notfall-Bergung des Patienten aus dem Brachytherapieraum ist eine spezielle Unterweisung nach Strahlenschutzverordnung nötig.
Personendosimetrie
Die Personendosimetrie ist vorgeschrieben für strahlenexponiertes Personal und Auszubildende oder Studenten, die sich zu Ausbildungszwecken in den Strahlenschutzbereichen aufhalten müssen. Die Auswertung erfolgt monatlich über die Strahlenschutzbehörde. Besucher oder Angehörige müssen für den Zeitraum des Aufenthaltes mit entsprechenden Überwachungsmaßnahmen ausgestattet werden, um die Körperdosis ermitteln zu können. Hierfür werden direkt ablesbare Dosimeter verwendet. Die Aufenthaltsdauer und die Körperdosis müssen dokumentiert werden.
Bauliche Maßnahmen
Der Beschleunigerbunker muss durch bauliche Strahlenschutzmaßnahmen gewährleisten, dass Personen außerhalb des Bunkers keine Dosis abbekommen können.
Um die Beschleunigerwände bei der Verwendung von hochenergetischer Strahlung in alle Richtungen möglichst undurchlässig zu machen, wird heutzutage meist Barytbeton (Baryt: „Schwerspat“, Bariumsulfat) verwendet. Je nach möglicher Höchstenergie und Ausstattung des Bunkers werden die Räume mit 1–2 m dicken Barytbetonwänden ausgestattet.
Ist der Raum mit einem Strahlenfang, auch Labyrinth genannt, ausgestattet, reicht eine Strahlenschutztür aus einem Verbundmaterial von bis zu 3 cm Blei und 30 cm Paraffin aus. In neueren Strahlentherapieanlagen wird aus Platzgründen meist auf ein Labyrinth verzichtet. Das Strahlenschutztor besteht hierbei aus Barytbeton, um die entsprechende Abschirmwirkung zu erreichen.
Durch die hochenergetische Strahlung kann die Raumluft aktiviert werden, wobei radioaktives N-13 und O-15 entstehen können. Es muss deswegen immer ein gut funktionierendes Lüftungssystem vorhanden sein, um einen stetigen Luftaustausch (10 Mal pro Stunde) zu gewährleisten.
Notfallbergung
Kommt es zu Problemen mit der Beschleunigeranlage (z. B. das Strahlenschutztor lässt sich nicht mehr öffnen, der Linearbeschleuniger schaltet nicht ab) muss ein Notfallkonzept das Vorgehen zur Bergung des Patienten aus dem Beschleunigerraum regeln.
Dazu gehört die Öffnung des Strahlenschutztors, entweder manuell oder mit Flaschenzug. Sollten es die baulichen Gegebenheiten nicht zulassen oder ist das Tor aus der Verankerung gerissen, muss die Feuerwehr hinzugerufen werden.
Die Maßnahmen und der Ablauf einer Notfallbergung muss standardmäßig mit dem Personal geübt werden, um im Ernstfall schnell und korrekt handeln zu können.
Ist das Öffnen des Bestrahlungsraumes während des Patientenbetriebs durch technische Probleme oder einen Defekt nicht möglich, sollten Sie als MTRA anhand des Notfallkonzeptes sofort reagieren. Lassen Sie dabei den Patienten nie außer Acht. Sprechen Sie sich mit einem Kollegen ab, wer die zuständigen Personen informiert, um Hilfe zu erhalten und wer mit dem Patienten über die Sprechanlage in Kontakt bleibt und diesen beruhigend informiert.
9.3 Aufbau und Funktion radioonkologischer Bestrahlungsgeräte
D. Dohr6 , C. Marks7 und J. Thiele8
(6)
Christiansgasse 14, 8750 Glarus, Schweiz
(7)
Klinik für Radioonkologie, Universitätsklinikum Tübingen, Hoppe-Seyler-Str. 3, 72076 Tübingen, Deutschland
(8)
Klinik für Strahlentherapie und Radioonkologie, Universitätsklinikum Carl Gustav Carus an der Technischen Universität Dresden, Fetscherstr. 74, 01307 Dresden, Deutschland
Das klassische, am häufigsten eingesetzte Behandlungsgerät in der Radiotherapie ist der Linearbeschleuniger, obwohl natürlich noch weitere Apparate und andere Bestrahlungsmethoden zur Abtötung von Tumorzellen zur Verfügung stehen.
9.3.1 Linearbeschleuniger
D. Dohr9 und C. Marks10
(9)
Christiansgasse 14, 8750 Glarus, Schweiz
(10)
Klinik für Radioonkologie, Universitätsklinikum Tübingen, Hoppe-Seyler-Str. 3, 72076 Tübingen, Deutschland
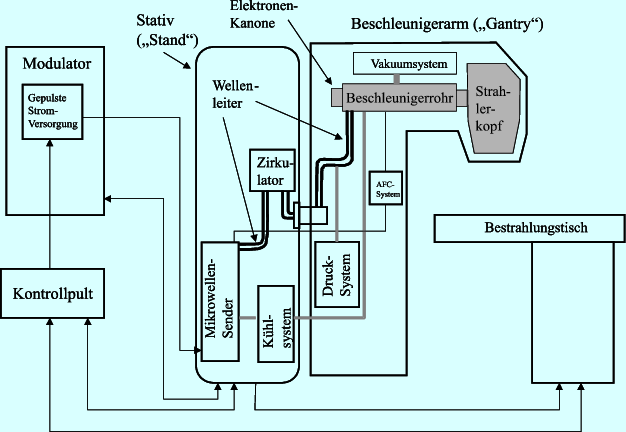
Der Linearbeschleuniger (Abb. 9.2) besteht aus einem Röntgengerät, das mit einem Beschleunigungsrohr als zusätzlicher Vorrichtung die Strahlen mit höherer Energie ausstattet. Man nennt sie ultraharte Röntgenstrahlung oder auch hochenergetische Photonenstrahlung, mit der es möglich ist, tiefer gelegene Tumoren zu erreichen – im Gegensatz zur konventionellen Röntgentherapie (Abschn. 9.3.7), die nur oberflächlich wirkt.
Der Beschleunigerarm, Gantry genannt, kann sich in einer Ebene um den Behandlungstisch drehen. Seine Position wird als Gantrywinkel angegeben. Der Strahlerkopf, der sich am Ende des Beschleunigerrohrs befindet, ist drehbar. Da sowohl der Behandlungstisch, die Gantry als auch der Strahlerkopf beweglich sind, hat man beinahe uneingeschränkte Möglichkeiten, um den Tumor aus allen Richtungen zu bestrahlen. Der Tischwinkel gibt dabei die Position des Tisches und der Kollimatorwinkel die des Strahlerkopfes an.
Bauteile
Elektronenkanone – Beschleunigerrohr – Strahlerkopf
Der Abschnitt, in dem die Elektronen erzeugt werden, wird als Elektronenkanone (engl. electron gun) bezeichnet. Die Beschleunigung der Elektronen erreicht man, indem am 1–2.5 m langen Beschleunigerrohr, das die Elektronen durchlaufen müssen, eine Wechselspannung mit hoher Frequenz angelegt wird. Das Ende des Beschleunigungsrohrs liegt im Strahlerkopf des Linearbeschleunigers. Dort wird der Elektronenstrahl mittels Magneten in einer Kreisbewegung um 270 Grad umgelenkt. Dadurch werden die bis dahin unterschiedlich hohen Energielevel der einzelnen Elektronen aneinander angeglichen, der Strahl gewinnt an Homogenität. Auch aus Platzgründen ist die Umlenkung sinnvoll, denn sonst wäre der Behandlungsraum riesig.
Bauteile für Photonenstrahlung im Strahlerkopf (Abb. 9.3)
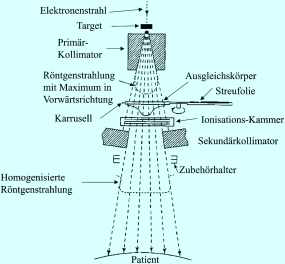
Abb. 9.3
Strahlenfelderzeugendes System. Anmerkung: Die abgebildete Skizze gibt den Geräteaufbau im Prinzip wieder. Medizinische Linearbeschleuniger können sich in der Form und in der Anordnung der Bauteile im Strahlerkopf unterscheiden. So ist z. B. der Elektronenfänger im Primärkollimator eingebaut oder erst am Ende des Strahlbearbeitungsprozesses. Auch beim Wechsel zwischen Photonenmodus und Elektronenmodus kennt man mehrere Methoden: Möglich ist u. a. ein Drehtisch (Karussell), auf dem der Ausgleichskörper für die Photonen und die Metallfolie für die Elektronen gelagert sind. Je nach Bedarf wird dieses Tablett in die benötigte Position rotiert. (Aus Wannenmacher 2006)
Beim Aufprall der beschleunigten Elektronen auf das Target entstehen hochenergetische Photonen, die keulen- bzw. birnenförmig aufgestreut werden. Das Target wird bei diesem Vorgang stark erwärmt, sodass zur Kühlung eine Wasserleitung und ein Kupferblock in der Maschine integriert sind. Die entstehenden Photonen werden größtenteils weiter vorwärts gestreut und gelangen durch den Primärkollimator hindurch. Ein Kollimator ist ein allgemeiner Begriff für Vorrichtungen, die dazu dienen, Photonen zu absorbieren, die sich nicht in Richtung des Nutzstrahls bewegen. In diesem Fall handelt es sich um einen Bleitrichter, der an den Wänden die Strahlen absorbiert, welche sich nicht auf den Patienten richten und somit keine therapeutische Wirkung haben. Im weiteren Strahlenverlauf ist ein Ausgleichsfilter aus Metall (Photonenausgleichskörper) angebracht, der die Photonenstrahlung homogenisiert: da die höchste Dosisintensität in der Mitte der keulenförmigen Strahlenwolke liegt, ist der Ausgleichsfilter dort am dicksten und zum Rand hin auslaufend.
Ein weiteres Element ist der Elektronenfänger (engl. beamstopper od. beamhardener). Er besteht aus Metall und fängt die weichen (niederenergetischen) Strahlungsanteile ab, sodass nur die höher energetischen Anteile durchgelassen werden. Man bezeichnet diesen Vorgang als „Aufhärtung“.
Bauteile für Elektronenstrahlung im Strahlerkopf
Will man nicht mit Photonen, sondern mit Elektronen behandeln, lässt man die Strahlung direkt austreten, ohne dass sie auf das Bremstarget prallt, das dabei zur Seite gefahren wird. Der Elektronenstrahl durchläuft ebenfalls den Primärkollimator. Statt auf den Ausgleichkörper treffen die Elektronen auf eine mikrometer-dicke Metallfolie (Streufolie), die den nadeldünnen Elektronenstrahl auf einen vergrößerten Durchmesser aufweitet.
Dosiskontrolle mit Monitorkammern
Unterhalb des Ausgleichsfilters sind zwei Durchstrahl-Ionisationskammern eingebaut, welche die Energiedosis in Monitoreinheiten (ME bzw. engl. monitor units, „MU“) messen. Die beiden Monitorkammern sind aus Überwachungsgründen unabhängig voneinander. Der Strahl wird automatisch abgeschaltet, wenn die voreingespeicherten MEs für das entsprechende Bestrahlungsfeld erreicht wurden. Bei Ausfall der ersten Messkammer erwirkt die zweite Kammer ein sofortiges Abschalten der Strahlung.
Installationen zur individuellen Feldeinstellung für jeden Patienten
Lichtvisier und Entfernungsmesser als Einstellhilfe
Im Strahlerkopf sind eine Lampe und ein Spiegel montiert, die exakt das Strahlenfeld als Lichtfeld wiedergeben, damit die MTRA eine visuelle Kontrolle bei der Feldeinstellung haben. Durch den Spiegel wird das zu bestrahlende Feld mittels einer Lichtquelle auf die Oberfläche des Patienten projiziert. Die Position der Lichtquelle hat denselben Abstand zur Haut bzw. Oberfläche wie das Bremstarget. Sie dient als optischer Entfernungsmesser und gibt den Fokus-Haut-Abstand (FHA oder engl. source skin distance, SSD) an, der bei den Feldeinstellungen eine wichtige Rolle spielt.
Blenden und Lamellenkollimator (MLC)
Vier Wolfram- oder Bleiblöcke (Blenden) begrenzen die 4 Feldränder. Sie werden auch Kollimatoren (Abschn. 9.3.1) genannt, ihre Seitenflächen sind der Strahlendivergenz angepasst. Die vier Blenden sind verschieblich, darüber definiert man die Feldlängen und die Feldbreiten (X1, X2, Y1, Y2). Diese rechteckigen Felder können nun zusätzlich durch Multileaf-Kollimatoren aus Wolfram variiert werden. Strenggenommen besteht der Multileaf-Kollimator (MLC) aus vielen dünnen Platten, auch Lamellen genannt. Schaut man aber auf den Strahlerkopf, so ist die 3. Dimension (Tiefe) verborgen, deshalb wird häufig von „Stäbchen“ gesprochen gemäß der für den Betrachter sichtbaren Form. Die Lamellen haben, je nach Geräteausstattung, verschiedene Breiten bis 10 mm. Damit gelingt eine millimetergenaue Anpassung des Bestrahlungsfeldes an die Kontur des Tumors. Manchmal kann das Gewebe besser geschützt werden, wenn die MLC, die vom linken und rechten Feldrand eingeschoben werden, von oben und unten kommen. In diesen Fällen dreht man das Feld bzw. seinen Kollimatorwinkel um 90 Grad.
Haltevorrichtungen
Zur Bestrahlung mit Elektronen wird ein Tubus zur Bündelung des Elektronenstrahls am unteren Ende des Strahlerkopfes befestigt. Je nach Wahl der Elektronen-Eindringtiefe und der Feldgröße ist ein unterschiedlich großer Tubus nötig. Patientennah kann man in den Tubus Bleirahmen einsetzen, die es erlauben, das eckige Bestrahlungsfeld zu verkleinern oder umzuformen. Manchmal gießt man dafür extra eine individuell angepasste Bleiform. Zur Einstellung erfolgt der direkte Hautkontakt des Rahmens auf der Haut, der FHA beträgt hierbei 95 cm.
Installationen zur Kontrolle der korrekten Feldeinstellung, IGRT
Vor der ersten Sitzung und in gewissen Abständen während der Behandlung wird überprüft und dokumentiert, ob bzw. dass auch tatsächlich exakt so bestrahlt wird, wie im berechneten Plan vorgegeben. Wenn diese Verifikationsaufnahme direkt vor der Bestrahlung erfolgt und nötige Korrekturen sofort vorgenommen werden, spricht man von IGRT (engl. image guided radiotherapy, bildgeführte Radiotherapie).
Die Kontrollaufnahmen der Bestrahlungsfelder werden entweder mit dem Therapiestrahl aus dem Linearbeschleuniger selbst angefertigt, bei einer Spannung im Megavolt-Bereich (MV), oder sie stammen aus einem zusätzlichen Röntgengerät bei einer Spannung im Kilovolt-Bereich (kV). Man vergleicht sie mit den DRR, die während des Planungsprozesses entstanden sind (Abschn. 9.6.9). Bei Abweichungen wird dementsprechend eine Korrektur vorgenommen, meistens als Verschiebung der Tischposition vertikal, horizontal und longitudinal. Einige Tische können sogar durch einen speziellen Tischaufbau eine Rotation bis zu einem gewissen Grad ausgleichen. Computerprogramme erleichtern die Arbeit, indem sie automatisch den Abstand von vorgegebenen Strukturen (z. B. Knochenkontur, Trachea, Zähne) ausmessen (matchen).
Die IGRT kann verfeinert werden, indem man zusätzlich Clips aus Metall (Marker) ins Gewebe einbringt. Damit ist das Zielvolumen eindeutiger festgelegt, Lageveränderungen von Organen sind sehr gut erkennbar.
Die Prostata bewegt sich je nach Stuhlfüllung im Rektum um mehrere Millimeter. Mit drei winzigen Goldmarkern, die man in die Prostata dauerhaft implantiert, erkennt man vor jeder Sitzung die tatsächliche Lage des Organs und passt die Einstellung für die Bestrahlung in o. g. Weise an.
Bei den neueren Geräten ist der Behandlungstisch mit dem Matching-Vorgang gekoppelt, sodass der Behandlungstisch auf Knopfdruck / Befehl auf die empfohlene Position fährt. Unverzichtbar ist dennoch die Plausibilitätskontrolle durch die MTRA, die die vorgenommenen Korrekturen kontrollieren müssen, da auch Computerprogramme nicht unfehlbar sind.
Feldaufnahmen in MV-Qualität
Die Verifikationsaufnahmen mit dem Linearbeschleuniger sind in der Bildqualität schlechter als diagnostische Röntgenbilder. Der Grund liegt im unterschiedlichen Verhalten von Strahlung (Photonen) mit Materie in Abhängigkeit des Energiebereichs. Während man in der Röntgendiagnostik mit geringen Energien arbeitet, die den Photoeffekt hervorrufen, ist der hauptsächliche Prozess in der Therapie mit Linearbeschleunigern der Comptoneffekt, der im Energiebereich zwischen 100 keV und 10 MeV beobachtet wird. Ab 1.022 MeV tritt in geringem Maß zunehmend auch der Paarbildungseffekt auf (Abschn. 2.1).
Technisch realisiert man die Aufnahmen (engl. Portal Images), indem am Linearbeschleuniger unter dem Behandlungstisch ein Schwenk-Arm mit dem Röntgendetektor (Imager) ausfährt. Bei optimaler Einstellung sind dennoch nur Strukturen mit großem Dichteunterschied voneinander abgrenzbar, wie z. B. knöcherne Strukturen der Wirbelsäule oder im Becken. Die Kontrolle wird unmittelbar nach der Belichtung am Computerbildschirm dargestellt. Sie kann aber ebenso mit einer tragbaren Speicherfolienkassette aufgenommen und an einem Auslesegerät ausgewertet werden. Diese Methode findet bei Bestrahlungsfeldern Anwendung, die zu groß für den Röntgendetektor sind.
Feldaufnahmen in kV-Qualität
Ein Bildgebungssystem in kV-Qualität benötigt zusätzliche Installationen am Linearbeschleuniger, nämlich zwei Arme (Abb. 9.4), die mit einem Röntgengerät einerseits und einem Flachbild-Detektor andererseits ausgerüstet sind. Vor der Bestrahlung werden orthogonale kV-Röntgenaufnahmen der Bestrahlungsfelder oder der Set-Up-Felder angefertigt (z. B. von 0 und 90 Grad).
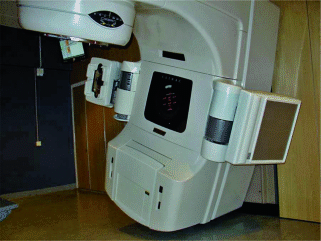
Abb. 9.4
Linearbeschleuniger mit Bildgebungssystem in kV-Qualität. (Aus Short 2013)
Cone-Beam-CT
Neuere Linearbeschleuniger besitzen ein Cone-Beam-CT , auch „Kegel-Strahl-CT, digitale Volumentomographie oder Mini-CT genannt, da es im Vergleich zum diagnostischen CT in Qualität und weiteren Bearbeitungsmöglichkeiten eingeschränkt ist. Es drehen sich die beiden Arme mit Röntgengerät und Detektor um den ausgefahrenen Behandlungstisch bzw. den Patienten. Die dabei aufgenommenen CT-Schichten werden mit den Schichten des Planungs-CT übereinandergelegt. Der Vorteil zu den 2D-kV-Röntgenaufnahmen ist, dass man einen direkten Vergleich der realen Aufnahmen hat und nicht auf einen Zwischenschritt mit rekonstruierten Aufnahmen (DRR) zurückgreifen muss. In den CT-Schichten können neben den Knochen auch Organe wie die Prostata und die Harnblase abgegrenzt werden.
Atemgesteuerte Bestrahlung (engl. respiratory gated radiotherapy)
Die Bestrahlung wird auf die Atembewegungen des Brustkorbs abgestimmt. Die Atemkurve wird aufgezeichnet, und die Strahlung schaltet sich immer nur in einem bestimmten Atemabschnitt ein, nämlich für die Zeitspanne, in der der Tumor bzw. das PTV in günstiger Position liegt.
Indikationen
Mit Atemsteuerung ist bei der Bestrahlung von Lungentumoren nur ein schmaler kranialer und kaudaler Sicherheitssaum nötig, da die atembedingte Tumorbewegung nicht berücksichtigt werden muss.
Ebenso schont die Methode bei linksseitigem Brustkrebs das Herz. Es wird nur in Inspiration bestrahlt, denn während dieser Phase ist der Brustkorb gedehnt, und die Lungen sind mit Luft gefüllt. Der Abstand zwischen Herz und Brustwand/Brust ist dadurch grösser als bei Exspiration, und das Herz erhält dementsprechend weniger Streustrahlung.
Sensorsystem und Planungs-CT
Der erforderliche Atemzyklus wird mit dem Patient geübt. Er soll regelmäßig, nicht zu tief und nicht zu flach atmen. Unterstützend sieht der Patient seine eigene Atemkurve auf dem Monitor (visuelle Rückwirkung). Die Aufzeichnung geschieht mit einem Sensorsystem: Auf dem Brustkorb des Patienten sind Reflektoren befestigt. Fest installierte Laserstrahlen von der Decke und den Wänden des Raumes treffen auf die Reflektoren, die den Strahl wie ein Katzenauge am Fahrrad zurückspiegeln. Die Rückstrahlung wird von einer Kamera aufgenommen. Aus Zeitpunkt, Winkel und Geschwindigkeit wird eine Kurve errechnet, bei der jede Phase der Atmung exakt bestimmt werden kann. Während des Planungs-CT ist gleichzeitig dieses Sensorsystem in Betrieb, das die Inspiration/Exspiration zum Zeitpunkt eines jeden Scan festhält.
Verarbeitung und Bestrahlung
Nun wird das zeitliche Bestrahlungsfenster festgelegt. Wenn z. B. die Bestrahlung nur bei Exspiration erfolgen soll, werden alle Scans in genau dieser Atemlage zusammengestellt. Gleichzeitig weiß man durch die Lasersensoren, wie hoch die Thoraxwand bei der Ausatmung steht. Der Linearbeschleuniger wird gemäß dieser Daten programmiert, sodass während der Bestrahlung die Strahlung ein- oder ausgeschaltet wird, je nach Position des Brustkorbes, die ihm vom Sensorsystem gemeldet wird. Ist der Bestrahlungsplan in üblicher Weise fertig erstellt, erfolgen die Ersteinstellung und alle weiteren Behandlungen in gleicher Lagerung inkl. Sensorsystem wie bei der Planung.
Gating oder Breath-Hold-Technik
Die o. g. Technik bezeichnet man als Gating (engl. gate, das Tor, das sich öffnet und schließt). Eine einfachere Methode stellt die Bestrahlung bei angehaltenem Atem (engl. breath hold) dar, die bevorzugt bei linksseitigem Brustkrebs zur Herzschonung angewandt wird. Die Vorbereitung mit Sensorsystem gestaltet sich gleich, nur dass auf das zeitintensive Training für die optimale Atemkurve verzichtet werden kann. Die Patientin atmet ein und hält den Atem an, während das Planungs-CT angefertigt wird. Bei den späteren Bestrahlungen wird genauso verfahren. Da die Behandlungszeiten sehr kurz sind, reicht üblicherweise eine Atemanhaltphase pro Feld völlig aus. Falls nicht, würde das Gerät wie beim Gating automatisch unterbrechen, sobald die Sensoren eine Brustkorbbewegung im Sinne einer Ausatmung bemerken und die Bestrahlung erst fortsetzen, wenn durch die nächste Einatmung wieder die optimale Weite des Brustkorbs erreicht ist.
9.3.2 Dosisverteilung im Gewebe
D. Dohr11 und C. Marks12
(11)
Christiansgasse 14, 8750 Glarus, Schweiz
(12)
Klinik für Radioonkologie, Universitätsklinikum Tübingen, Hoppe-Seyler-Str. 3, 72076 Tübingen, Deutschland
Tiefendosisverlauf
Die Strahlung dringt ins Gewebe ein und überträgt dabei seine Energie. Elektronen und Photonen zählen beide zur Partikelstrahlung (schnell bewegte Atome, Ionen oder Elementarteilchen mit Ruhemasse), sind aber unterschiedlich schwer und haben ein unterschiedliches Verhalten, wann und in welchem Maße sie ihre Energie abgeben. Diagramme mit sog. Tiefendosiskurven (Abb. 9.5) charakterisieren den Dosisverlauf im Gewebe.
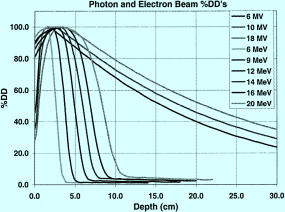
Abb. 9.5
Tiefendosisverlauf für 6–18 MeV Elektronen und 6–18 MV Photonen. Y-Achse: Dosis in Prozent, x-Achse: Gewebetiefe. (Aus Purdy et al. 2012)
Faktoren, die den Verlauf der Tiefendosiskurve beeinflussen
Strahlenmodalität: Mit hochenergetischen Photonen erreicht man tiefer gelegene Volumina. Elektronen verwendet man bei oberflächlichen Prozessen, siehe Tiefendosiskurven (Abb. 9.4)
Strahlenenergie: Höhere Energien dringen tiefer ein. 18 MV-Photonen reichen weiter als 6 MV-Photonen. 12 MeV Elektronen reichen weiter als 6 MeV Elektronen.
Feldgröße: Die Reichweite der Photonen- und der Elektronenstrahlung erhöht sich mit zunehmender Feldgrösse. Dagegen zeigen Photonen und Elektronen ein unterschiedliches Verhalten in der Oberflächendosis bei Änderung der Feldgröße (Abschn. 9.3.2).
Fokus-Haut-Abstand (FHA Abschn. 9.3.1): Je grösser der Abstand, desto geringer die Dosis an der Oberfläche und desto grösser die Reichweite in die Gewebetiefe.
Durchstrahltes Material: Je dichter das Gewebe, z. B. Weichteilgewebe gegenüber luftgefüllter Lunge, desto mehr wird die Strahlung absorbiert. Sie gelangt deshalb weniger tief ins Gewebe.
Photonen
Beim Auftreffen auf die Haut bzw. Oberfläche gibt der Photonen strahl etwa 70–80 % seiner Dosis ab. Er dringt auf seiner Bahn weiter ins Gewebe ein und gewinnt durch die Sekundärelektronen wieder an Energie. Diese Elektronen gehören zu den Molekülen des Gewebes, sie werden durch den Photonenstrahl angestoßen und bewegen sich dann ebenfalls fort. Das Phänomen bezeichnet man als Aufbau-Effekt: die maximale Dosis entfaltet sich erst in der Tiefe des Gewebes. Je höher die Energie des Photonenstrahls ist, desto weniger Dosis erhält die Haut und desto tiefer liegt das Dosismaximum im Gewebe (Abb. 9.5). Mit 18 MV-Photonen schont man die Haut stärker als mit 6 MV Photonen und man erreicht tiefer gelegene Tumoren. Mit zunehmender Feldgröße erhöht sich allerdings die Dosis an der Oberfläche wieder.
Elektronen
Elektronen entwickeln ihr Dosismaximum ebenfalls unter der Haut, sie haben aber anschließend ein anderes Verhalten als die Photonen. Der Grund dafür ist, dass die Photonen nach dem Durchdringen der Haut die Richtung ihrer Bewegung beibehalten und tief in das Gewebe vordringen, während die Elektronen nur z. T. auf ihrer Bahn vorwärts wandern und eben auch nach allen Seiten hin streben. Daraus resultiert, dass man mit Photonen tiefergelegene PTV besser erreicht. Für oberflächliche Prozesse verwendet man gerne Elektronen, da sie dafür zwei günstige Merkmale besitzen: eine ausreichende Reichweite und einen steilerer Dosisabfall als die Photonen. Gesundes Gewebe hinter bzw. unterhalb des Zielvolumens wird dadurch fast vollständig geschont.
Spezielle Eigenschaften der Elektronen
Mit Erhöhung der Energie kann man zwar wie bei den Photonen die Reichweite im Gewebe vergrößern: So liegt mit 6 MeV-Elektronen das Dosismaximum in 12 mm Gewebstiefe und mit 12 MeV-Elektronen in 24 mm Gewebstiefe (das ist eine einfache Rechnung: man multipliziert die Energie mit 2). Im Gegensatz zu den Photonen erhöht sich aber die Dosis auf der Haut mit steigender Energie.
Das Dosismaximum bei Elektronen ist nur abhängig von der Feldgröße, wenn die Bestrahlungsfelder kleiner als 5 cm × 5 cm sind. In diesem Fall zieht es das Dosismaximum mehr und mehr an die Oberfläche.
Bei kleinen Bestrahlungsfeldern zieht sich die Dosis an den seitlichen Feldrändern oberflächennah zusammen. Die Form der Dosisverteilung erinnert an einen Pinsel. So wird unter Umständen ein 1 cm großer Hauttumor in einem 2 cm großen runden Feld nicht mit ausreichender Dosis bestrahlt.
9.3.3 Dosisverteilung im Bestrahlungsplan
D. Dohr13 und C. Marks14
(13)
Christiansgasse 14, 8750 Glarus, Schweiz
(14)
Klinik für Radioonkologie, Universitätsklinikum Tübingen, Hoppe-Seyler-Str. 3, 72076 Tübingen, Deutschland
Eine Gesellschaft, die International Commission on Radiation Units and Measurements (ICRU), hat Empfehlungen für die Dosisverschreibung in der Strahlentherapie erarbeitet, veröffentlicht als Report ICRU 50 und ICRU62. Darin sind neben der Definition von GTV, CTV und PTV (Abschn. 9.6.6) beschrieben, wie bei der Erstellung eines Bestrahlungsplans vorgegangen werden soll. Unter anderem wird eine homogene Dosisapplikation im Zielvolumen PTV gefordert mit einem Minimum von 95 % und einem Maximum von 107 %.
Hilfsmittel zur Umformung der Dosisverteilung
Optimal für die Bestrahlung wäre es, wenn der Körper einem Wasserquader mit homogener Dichte und gerader Linienführung gleichen würde. Um die physikalischen Anforderungen einer Strahlentherapie trotzdem zu erfüllen, ist es manchmal nötig, mit Hilfsmitteln die Unebenheiten der Körper- und Organkonturen auszugleichen.
Keilfilter
Keile aus Metall mit unterschiedlicher Dicke sind entweder im Gerät eingebaut oder werden von Hand in den Strahlengang eingeschoben. Je nach Bedarf werden sie entlang des Strahlengangs oder quer dazu, mit dem dicken oder spitzen Ende voran positioniert. Eine Sonderform, der dynamische Keil ist gar kein Keil, sondern nur die Bewegung der Blende über das Feld mit dem gleichen Effekt. Es ergibt sich eine Ablenkung der Dosisverteilung (Abb. 9.6). Je nach dem Winkel, den die 50 %-Isodose (Abschn. 9.3.4) mit der Horizontalen bildet, werden die Keilfilter als 10, 15, 20, etc. Grad-Keil (engl. wedge-15-20-30) bezeichnet.
Abb. 9.6a,b
Isodosenverteilung ohne (a) und mit (b) Keilfilter
Moulagen
Mithilfe von Moulagen (auch Bolus oder Flab genannt), die die gleiche Dichte besitzen wie Körpergewebe (körperäquivalentes Material) kann man bei oberflächlichen Prozessen (Hautmetastasen, Operationsnarben, Hautlymphome o. ä.) eine optimale Dosisabdeckung erreichen. Es wird eine Moulage, z. B. aus Wachs, Gelkissen, Wasserkissen, Plexiglas, auf die Haut gelegt. Statt auf die Haut, trifft der Strahl nun zuerst auf die Moulage und entwickelt ab diesem Moment den für ihn typischen Tiefendosisverlauf. Die Isodosen werden angehoben, sie verziehen sich zur künstlichen Oberfläche mit der Konsequenz, dass sich das Dosismaximum jetzt auf das Niveau des PTV ausbreitet.
Der Körperdurchmesser kann mit Moulagen künstlich verbreitert werden, um eine unzureichende Dosisverteilung auszugleichen. Z. B. wird bei der Ganzkörperbestrahlung (a. p./p. a.) der Hals-Schulter-Übergang ausgepolstert. Bei der konventionellen Röntgentherapie legt man am abgewinkelten Ellenbogen ein Kissen an.
Satelliten-Bleiblöcke
Satelliten-Bleiblöcke haben den Zweck der individuellen Feldbegrenzung oder der Ausblockung strahlenempfindlichen Gewebes inmitten des Bestrahlungsfeldes. Im Zeitalter von IMRT, VMAT und Tomotherapie (Abschn. 9.3.5) wird der Einsatz dieser Bleiblöcke, die auf einem Träger in den Strahlengang gesetzt werden, immer seltener. Ein Beispiel ist die Lungenabdeckung bei Bestrahlung eines Mantelfeldes (Kap. 22).
Halbfeldtechnik (Halfbeam )
Bei dieser Technik wird die Divergenz der Strahlen durch Schließen einer Blende „abgeschnitten“.
Bei Bestrahlung der HWS über seitliche Felder erhält der Rachen durch die Strahlendivergenz eine Dosis, die zu Schluckbeschwerden führen könnte. Schließt man nun die ventrale Blende bis zum Zentralstrahl, verläuft der Strahl im Bereich Wirbelkörpervorderkante / Rachenschleimhaut nicht mehr divergent, sondern parallel und die Rachenschleimhaut wird geschont.
9.3.4 Bestrahlungstechniken
D. Dohr15 und C. Marks16
(15)
Christiansgasse 14, 8750 Glarus, Schweiz
(16)
Klinik für Radioonkologie, Universitätsklinikum Tübingen, Hoppe-Seyler-Str. 3, 72076 Tübingen, Deutschland
Wichtige Begriffe und Definitionen
Isozentrum und isozentrische Bestrahlung am Linearbeschleuniger
Das Isozentrum ist der Punkt, der auf dem Zentralstrahl in 100 cm Abstand zum Target liegt und in dem sich die Achsen von Gantry, Kollimator und Tisch kreuzen. Der Patient wird im Planungs-CT entsprechend gelagert, damit sich das Isozentrum in der Mitte des Zielvolumens befindet. Gelingt dies manchmal nicht, wird am Planungscomputer errechnet, wie weit und in welche Richtungen der Patient bei der Ersteinstellung mit dem Tisch verschoben werden muss (off-set), um die Vorgabe zu erfüllen.
Bei der isozentrischen Bestrahlung treffen sich die Zentralstrahlen aller Felder im Isozentrum. Der Abstand zwischen Target und dem Isozentrum (Fokus-Isozentrum-Abstand) ist definiert für alle Felder und beträgt 100 cm. Darüber ergibt sich auch der Fokus-Haut-Abstand (FHA):
Liegt das Isozentrum 9 cm unter der Haut, beträgt der FHA 91 cm.
Die Dosierung muss nicht unbedingt Bezug auf das Isozentrum nehmen. Gemäß Richtlinien von ICRU 50 und ICRU 62 kann man auch einen anderen Punkt innerhalb des Zielvolumens auswählen, den sog. Normierungspunkt, auf den 100 % der Dosis verordnet sind.
Koplanare Bestrahlung
In der herkömmlichen Radiotherapie legt man die Zentralstrahlen aller Felder in eine Ebene, die typischerweise quer zur Patientenachse verläuft (koplanare Bestrahlung). Bei der Stereotaxie (Abschn. 9.3.5) wird nicht-koplanar bestrahlt. Dazu ist es manchmal nötig, dass der Patient bzw. der Tisch während einer Sitzung neu ausgerichtet wird. Einen Vergleich zeigt Abb. 9.7.

Abb. 9.7
Nicht koplanare Stereotaxie mittels 10 Felder im Vergleich zu koplanarer VMAT
Isodosen
Isodosen stellen Punkte mit gleicher Dosis dar. Werden sie über Linien miteinander verbunden, spricht man von Isodosenkurven.
Einfache Techniken ggf. unter Einsatz des Simulators
Bei den einfachen Techniken werden Felder homogen bestrahlt. Stehfelder und opponierende (sich gegenüberliegende) Felder können statt mithilfe des Planungs-CT auch am Simulator eingestellt werden.
Am Simulator wird die Bestrahlungs-Situation nachempfunden („so getan, als ob“, „simuliert“). Die Anlage besteht aus dem Behandlungstisch und einem diagnostischem Röntgenapparat, der genau wie ein Linearbeschleuniger aussieht und ebenso bewegt werden kann.
Per Röntgen-Durchleuchtung orientiert man sich an den Knochenstrukturen und legt die Bestrahlungsfelder bzw. -volumina (Länge, Breite, Tiefe) fest. Außerdem werden die Gantry-, Kollimator- und Tisch-Winkel bestimmt und der Fokus-Haut-Abstand (FHA) abgelesen. Zum Abschluss dokumentiert man die Felder und das Isozentrum mit zwei orthogonalen Röntgenaufnahmen (z. B. 0 und 90 Grad). Nun werden die Bestrahlungsfeldkonturen und die Lasermarkierungen auf die Haut gezeichnet.
Neuere Abteilungen haben aus Platz- und Kostengründen auf die Anschaffung eines Simulators verzichtet und planen auch die einfachen Techniken mithilfe des Planungs-CT.
Stehfeld
Die einfachste Technik ist das Stehfeld , bei dem die Feldgröße, die Herdtiefe und die Energie festgelegt sind. Einzelfelder sind nur für oberflächlich gelegene Zielvolumina geeignet, z. B. bei der Bestrahlung von Wirbelkörpern, Weichteiltumoren oder Rippenmetastasen. Bei der Stehfeldtechnik gelingt die PTV-Abdeckung und gleichzeitige Schonung des gesunden Gewebes oft besser mit Elektronen als mit Photonen. Das Stehfeld wird entweder mit Fokus-Haut-Abstand von 100 cm eingestellt oder isozentrisch: Liegt das Isozentrum in 3 cm Tiefe, beträgt der Fokus-Haut-Abstand 97 cm. Abb. 9.8 zeigt eine typische Isodosenverteilung bei Stehfeldbestrahlung.
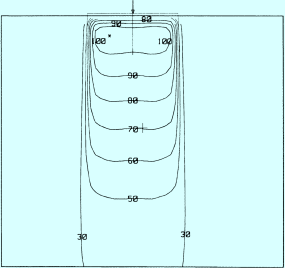
Abb. 9.8
Isodosenverlauf bei Stehfeld-Bestrahlung
Gegenfelder
Bei tiefer im Körper gelegenen Zielvolumina ist ein Stehfeld nicht geeignet, da mit sehr hohen Energien gearbeitet werden müsste, um das PTV mit einer ausreichenden Dosis abdecken zu können. Dabei würde allerdings gleichzeitig viel gesundes Gewebe im Strahlenkorridor unnötig belastet werden. Durch Gegenfelder (opponierende Einzelfelder) wird die Strahlenbelastung des gesunden Gewebes halbiert, denn sie wird auf zwei Eintrittsfelder verteilt. Zwei sich gegenüber liegende Felder (z. B. Gantry-Winkel 0 und 180 Grad oder 90 und 270 Grad) decken in vielen Fällen (Extremitäten, Gehirn, Wirbelsäule) das Zielvolumina ausreichend ab und sind einfach am Simulator zu planen und einzustellen. Abb. 9.9 zeigt eine typische Isodosenverteilung bei Gegenfeldfeldbestrahlung.
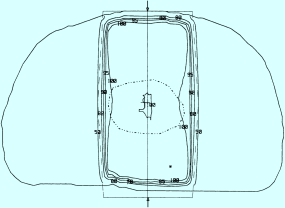
Abb. 9.9
Isodosenverlauf bei Gegenfeld-Bestrahlung
Mehrfeldertechnik – konformale Bestrahlung
Die klassische konformale Bestrahlungstechnik ist das Mehrfelder-Verfahren, bei dem die Felder zusätzlich durch die unter Abschn. 9.3.4 aufgeführten Methoden optimal der Zielkontur angepasst werden. Sie ist zur Einstellung am Simulator zu kompliziert. Man benötigt die exakten Körperquerschnitte und ein Computerprogramm für die Berechnung der Dosisverteilung. Man würde dafür ein Planungs-CT veranlassen (Abschn. 9.6.7). Bei Bestrahlung über mehrere Felder schmiegen sich die Isodosen enger an das PTV an, mit dem Effekt, dass die Dosis außerhalb des Zielvolumens steiler abfällt und das gesunde Gewebe besser geschont werden kann. Außerdem erlaubt die Kombination mehrerer Felder eine erhöhte Variation, was den Einsatz von Keilfiltern, unterschiedliche Gewichtung der Bestrahlungsfelder, MLC etc. betrifft. Der Plan kann dadurch individueller gestaltet werden. Abb. 9.10 zeigt eine typische Isodosenverteilung bei Mehrfeldfeldbestrahlung.
Abb. 9.10
Isodosenverlauf bei Mehrfelder-Bestrahlung
Bestrahlung mit inhomogener Dosisverteilung
Während bei Stehfeld-, Gegenfeld- und Mehrfeldtechnik die Dosis über das Feld gleichmäßig verteilt ist (homogen), werden bei den speziellen Techniken Dosismodulationen vorgenommen: innerhalb eines Feldes gibt es Bereiche mit hoher und mit niedriger Dosis.
IMRT
Die IMRT (Intensitätsmodulierte Radiotherapie ) stellt ein weiterentwickeltes Verfahren der konformalen Bestrahlung dar, bei der die nötige Dosis aus wenigen unterschiedlichen Richtungen auf den Patienten appliziert wird. Mit der relativ neuen Technik der IMRT ist es nun möglich, aus einer Vielzahl von verschiedenen Winkeln, bzw. über viele verschiedene Gantrypositionen die Dosis noch exakter auf den Patienten einzustrahlen.
Während der Bestrahlung wandern die Multileaf-Lamellen über das Bestrahlungsfeld. Dies geschieht entweder in Sliding Window-Technik, die Bestrahlung läuft, während sich die MLC bewegen oder in Step and Shoot-Technik, die Bestrahlung wird während der Bewegung der MLC unterbrochen. Dadurch lässt sich die Dosis von Punkt zu Punkt variieren. So kann man Tumore mit hoher Dosis bestrahlen und empfindliche Organe, die in direkter Nähe liegen, besser schonen, weil die reduzierte Dosis exakter an die Organkontur angeformt werden kann.
Der Nachteil der Methode liegt im „Dosisbad“ für das gesunde Gewebe: Da sehr viele Einstrahlrichtungen notwendig sind, wird viel gesundes Gewebe mit niedriger Dosis bestrahlt – im Gegensatz zur konformalen Bestrahlung, bei der im Vergleich weniger gesundes Gewebe im Strahlenkorridor liegt, das aber mit höherer Dosis belastet wird. Ob sich daraus gesundheitliche Folgen ergeben, kann heutzutage noch nicht sicher beurteilt werden.
VMAT
Die Volumetric Modulated Arc Therapy (VMAT) ist eine Weiterentwicklung der IMRT-Technik: Die Anzahl der kleinen dosismodulierten Felder nimmt zu, die in vielen unterschiedlichen Gantry-Positionen bestrahlt werden. Dazu bleibt die Gantry nicht mehr auf den einzelnen Positionen stehen, sondern bewegt sich im Kreis oder Halbkreis. Die Bestrahlungsdauer verkürzt sich dadurch deutlich. Die Dosisverteilung ähnelt derjenigen der Tomotherapie (Abschn. 9.3.6)
9.3.5 Linearbeschleuniger speziellen Bautyps
D. Dohr17 und C. Marks18
(17)
Christiansgasse 14, 8750 Glarus, Schweiz
(18)
Klinik für Radioonkologie, Universitätsklinikum Tübingen, Hoppe-Seyler-Str. 3, 72076 Tübingen, Deutschland
In den letzten Jahren wurden Linearbeschleuniger entwickelt, die ebenfalls Photonen erzeugen und ausstrahlen, aber bautechnisch so verändert sind, dass sie ganz bestimmte Bedürfnisse erfüllen.
Tomotherapie
Das Tomotherapiegerät ist eine Kombination aus Linearbeschleuniger und Computertomogramm. Es besteht aus einem breiten Ring, auf dem sich der Linearbeschleuniger kreisförmig bewegt (genau wie die CT-Röntgenröhre in der Diagnostik) und Strahlen mit einer Energie von 6 MV aussendet. Zusätzlich wird der Behandlungstisch kontinuierlich vorwärts durch den Ring geschoben. Im Ring ist gegenüber der Strahlenquelle ein CT-Detektor integriert. Damit wird vor jeder Bestrahlungssitzung ein CT in 6 MV-Qualität aufgenommen, das sofort die korrekte Lage des Patienten überprüft. Anschließend erfolgt die Behandlung in intensitätsmodulierter Weise, d. h. der Strahl wird durch Schlitz- und Multileaf-Lamellen variiert (vgl. IMRT Abschn. 9.3.5).
Die Vorteile des Tomotherapiegerätes liegen darin, dass man mehrere Volumina in einer Prozedur bestrahlen kann (z. B. HWK 3–5 und BWK 4–7), dass lange Bestrahlungsvolumina, wie z. B. eine Spinalachse (ZNS und Wirbelkanal) ohne Feldanstückelungen gelingen und dass bei schalenförmigen Zielvolumina das Nachbargewebe optimal geschont werden kann (z. B. Aussparung des Gehirns bei Basaliomen der Kopfhaut).
Stereotaktische Strahlentherapie
Der Begriff Stereotaxie leitet sich vom Griechischen ab. „Stereo“ bedeutet räumlich und „taxis“ ist die Anordnung. Damit bezeichnet man eine Radiotherapie, die räumlich gezielt und hoch präzise appliziert wird. Die Methode wurde für Hirntumore entwickelt, wird nun aber auch im restlichen Körper als Body-Stereotaxie z. B. für Primärtumore und Metastasen in Lunge und Leber eingesetzt, solange der Tumordurchmesser nicht grösser als 3 cm ist.
Die Behandlung erfolgt über zahlreiche, sehr kleine Bestrahlungsfelder des Linearbeschleunigers in nonkoplanaren Bögen (Abschn. 9.3.4 und Abb. 9.7). Die Begrenzung wird entweder mit Mikro-MLC oder mit einem Lochkollimator (Bleiblende aus Wolfram mit einem Loch von 2– 50 mmDurchmesser) vorgenommen.
In der eigentlichen Stereotaxie (engl. Stereotactic Radiotherapy, SRT) wird 3–5 Mal mit jeweils hohen Einzeldosen behandelt. Man spricht von Radiochirurgie ( engl. Stereotactic Radiosurgery, SRS), wenn die hohe Dosis (12–25 Gy) auf einmal appliziert wird.
Die hohe Zielgenauigkeit ist insbesondere bei der Hirnbestrahlung äußerst wichtig, da in direkter Nähe des Tumors (z. B. beim Akkustikusneurinom, Meningeom) hoch radiosensible Risikoorgane liegen. Man erreicht sie entweder durch Immobilisation des Patienten oder durch ein spezielles System (Cyberknife), das die Bewegungen des Patienten bzw. des Zielvolumens ausgleicht.
Eine absolute Immobilisation gelingt mit einem Ring, der in die Schädelkalotte des Patienten geschraubt wird. Dies wird vor allem bei der Radiochirurgie angewandt, bei der durch die sehr hohe Dosis eine Lageveränderung bzw. die ungenaue Dosisapplikation um wenige Millimeter fatale Folgen haben kann. Nachteil der Methode ist das Infektionsrisiko und die Unbequemlichkeit für den Patienten. Aus diesen Gründen wird der Ring nur für kurze Zeit getragen.
Eine unblutige Methode ist Kombination aus Maske, Beißblock und einem Rahmen mit Fixpunkten am Kiefer, den äußeren Gehörgängen, der Nase und des Hinterkopfes.
Das Cyberknife ist ein Roboter-gesteuerter 6 MV-Linearbeschleuniger mit einem mehrgelenkigen Arm, kombiniert mit einem Ortungssystem aus zwei Röntgenanlagen, die an der Raumdecke befestigt sind. Während der Behandlung werden ständig orthogonale Röntgenaufnahmen angefertigt und mit dem Bildmaterial aus der CT-Planung verglichen. Dementsprechend wird die Positionierung des Patienten bzw. des Behandlungstisches unter der laufenden Bestrahlung angepasst. Das Gerät eignet sich sehr gut für die Body-Stereotaxie, bei der die Lage des Zielvolumens durch Atmung und andere Organbewegungen ständig wechselt. Der Tumor muss dafür mit einem röntgendichten Material markiert werden. In der Lunge wird mittels Bronchoskopie ein Metallclip in der Nähe des Tumors platziert. In der Leber geschieht die Markerapplikation durch Punktion. Bei Hirntumoren reicht eine Maskenfixation aus.
Intraoperative RT
Die intraoperative RT (IORT) bleibt wegen des enormen Aufwands hochspezialisierten Zentren vorbehalten. In einem Operationsaal mit Linearbeschleuniger, der deshalb den Strahlenschutz-Gesetzen unterliegt, wird nach Entfernung des Tumors am offenen Operationsfeld das Tumorbett unter sterilen Bedingungen über ein Elektronenstehfeld bestrahlt, z. B. bei Pankreaskarzinomen, fortgeschrittenen Rektumkarzinomen oder speziellen Weichgewebstumoren. Ziel ist die Applikation einer hohen Dosis, während die Risikoorgane aus dem Feld herausgehalten werden können. Oft ist zusätzlich eine postoperative fraktionierte Strahlentherapie notwendig, weil die erforderliche Dosis (z. B. 50 Gy bei Adenokarzinom in der adjuvanten Situation (Abschn. 9.5) dem gesunden Gewebe nicht auf einmal zugemutet werden kann. Die Höhe der intraoperativen Dosis hängt von der Radiosensibilität der Nachbarorgane und der Größe des Bestrahlungsvolumens ab. Die noch erforderliche Restdosis und Fraktionierung wird nach dem linear-quadratischen Modell (Abschn. 9.4.7) errechnet, das die biologische Wirksamkeit unterschiedlicher Bestrahlungsprotokolle angibt.
Bei brusterhaltender Operation eines Mammakarzinoms wird zur Zeit in Studien untersucht, ob ein intraoperativ gegebener Boost mittels Elektronen oder kV-Röntgenstrahlen die postoperative Radiotherapie in bestimmten Fällen ersetzen oder sinnvoll ergänzen kann.
9.3.6 Röntgentherapiegeräte
D. Dohr19 und C. Marks20
(19)
Christiansgasse 14, 8750 Glarus, Schweiz
(20)
Klinik für Radioonkologie, Universitätsklinikum Tübingen, Hoppe-Seyler-Str. 3, 72076 Tübingen, Deutschland
Röntgentherapie geräte findet man leider nur noch selten in radioonkologischen Einrichtungen. Aus epidemiologischen Gründen (die Menschen werden älter und bleiben länger körperlich aktiv) steigt jedoch die Nachfrage. Denn mithilfe dieses Apparates lassen sich typische Erkrankungen des Alters (Abschn. 9.3.6) sehr gut behandeln.
Zur Radiotherapie im kV-Bereich wird ein konventioneller Röntgenapparat verwendet, der aber mit höherer Spannung als in der Diagnostik ausgestattet ist, sodass die Röntgenstrahlen mit einer Energie zwischen 30–200 kV therapeutisch eingesetzt werden können. Die weiche, niederenergetische Strahlung wird mittels Metallfilter absorbiert, da sie zur Behandlung ungeeignet ist. Mehrere Filter aus Beryllium, Aluminium oder Kupfer mit unterschiedlicher Dicke stehen zur Auswahl. Früher wurden sie per Hand eingelegt, in den neueren Geräten geschieht das automatisch. Über den Filter und die Röhrenspannung wird die Eindringtiefe der Röntgenstrahlen ins Gewebe bestimmt. Auch der Fokus-Haut-Abstand beeinflusst die Dosisverteilung, meistens wird aber von Seiten des Geräteherstellers nur eine Distanz, z. B. 40 cm, zugelassen. Gläserne Tuben fixieren diesen Abstand. Sie sind rechteckig bis ungefähr zu einer Größe von 10 × 15 cm oder rund bis minimal 2 cm Durchmesser. Das obere Ende des Tubus ist am Strahlerkopf eingehängt, das untere Ende des Tubus berührt die Haut des Patienten. Manchmal ist es für eine ausreichende Dosisverteilung auch nötig an einer Körperkontur eine Moulage anzulegen, z. B. um die Spitze des abgewinkelten Ellbogens (Abschn. 9.3.4).
Indikationen
Entzündlich-degenerative Erkrankungen
Bei vielen Formen von Fersenschmerzen (Achillodynie, Fasciitis plantaris, Fersensporn) und anderen entzündlich-degenerativen Erkrankungen, wie z. B. beim Tennisellbogen (Epicondylitis humeroradialis) besteht neben der (altersbedingten) Abnutzungserscheinung eine Entzündung der Weichteile (Bindegewebe, Bänder, Sehnen) mit den klassischen Merkmalen Schmerz, Rötung und Schwellung. In diesen Fällen ist eine Röntgentherapie mit kleinen Einzeldosen zwischen 0.5 und 1 Gy und Gesamtdosen von ca. 6 Gy, auch Reizbestrahlung genannt, sehr effektiv. Beobachtet werden eine Linderung oder eine komplette Rückbildung der Schmerzen, verbunden mit verbesserter Beweglichkeit. Der genaue Wirkmechanismus ist immer noch unerforscht. Wahrscheinlich wird der entzündliche Anteil der Erkrankung durch die Radiotherapie positiv beeinflusst, evtl. durch Wirkung auf die bei Entzündung einwandernden Zellen und Plasmaproteine. Die Schwellung (Ansammlung von Gewebeflüssigkeit) ist rückläufig, das Weichteilgewebe wird vom Druck entlastet und die Entzündung heilt aus.
Hauttumore
Basaliome und Spinaliome, deren operative Entfernung kosmetisch unschöne Ergebnisse liefern würden (z. B. an der Nase, Lippe) oder mit funktionellen Einschränkungen verbunden wären (z. B. am Auge) können mit konventioneller Therapie erfolgreich behandelt werden. Eine Hypofraktionierung, z. B. 1 × 7 Gy / Woche bis 49 Gy ist gut durchführbar und kommt den meistens hochbetagten Patienten sehr entgegen. Andere übliche Schemata sind 3 × 4 Gy / Woche bis 48 Gy oder 52 Gy oder normofraktioniert (Standardfraktion) mit 5 × 2 Gy / Woche bis 60 Gy.
9.3.7 Brachytherapie
Stay updated, free articles. Join our Telegram channel

Full access? Get Clinical Tree