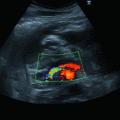
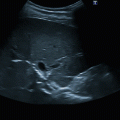
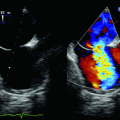
Abb. 6.1
Herzzyklus
Globale systolische LV‑Funktion und LV‑Größe
Die globale systolische LV‑Funktion wird im Wesentlichen durch die linksventrikuläre Ejektions ‑ oder Auswurffraktion (EF ) beschrieben. Hier findet in der Regel die modifizierte Volumetrie nach Simpson (mono‑ oder biplane Scheibchensummationsmethode in der 2D‑Echokardiographie) Anwendung. Zur Abschätzung der linksventrikulären Pumpfunktion – insbesondere in Notfallsituationen – ist, einen ausreichend erfahrenen Untersucher vorausgesetzt, die Abschätzung mit bloßem Auge ausreichend (Eyeball- versus Trackball-Methode). Wichtig ist, dass zusätzlich der linke Ventrikel von verschiedenen Anlotpositionen beurteilt wird, um das Vorliegen regionaler Wandbewegungsstörungen (WBST) auszuschließen (▶ Abschn. 6.1.2, ▶ Kap. 7). Sollten WBST nachgewiesen werden, muss die EF nach Simpson biplan bestimmt werden (im Vier- und Zweikammerblick). Bei Ausschluss von WBST reicht die monoplane Bestimmung im Vierkammerblick aus. Voraussetzung zur verlässlichen EF‑Bestimmung ist die klare Identifizierung der Endokardkontur. Bei schlechten Schallbedingungen kann keinesfalls aus der Bewegung des Perikards auf die LV‑Funktion geschlossen werden. Sollte die Schallqualität nicht ausreichend sein, kann unter Berücksichtigung der Kontraindikationen der Einsatz eines Ultraschallkontrastmittels zur LV‑Opazifikation (LVO) erfolgen. Abseits der EF‑Bestimmung ist natürlich die Größenbestimmung des LV bedeutsam, u. a. da eine chronische Reduktion der systolischen LV‑Funktion eine LV‑Dilatation nach sich zieht.
Normwerte im Folgenden (nach Lang et al. 2005):
Die Ejektionsfraktion (EF) stellt den wesentlichen Parameter (3‑dimensionale Größe) zur Beurteilung der linksventrikulären Funktion dar (EDV, enddiastolisches Volumen; ESV, endsystolisches Volumen):
EF = (EDV − ESV)/EDV × 100 %
Zu Normwerte und Gradeinteilung, ◘ Abb. 6.2, ◘ Abb. 6.3, ◘ Tab. 6.1. Im Gegensatz zu allen anderen Parametern in diesem Kapitel gelten die angegebenen EF‑Grenzwerte für beide Geschlechter.
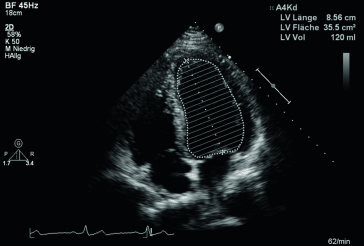
Abb. 6.2
EF‑Quantifizierung nach Simpson, diastolische Messung

Abb. 6.3
EF‑Quantifizierung nach Simpson, systolische Messung
Tab. 6.1
Einteilung der globalen linksventrikulären systolischen Funktion (LV‑EF)
LV‑EF
LV‑EF (%)
Normal
>55
Leicht eingeschränkt
45–54
Mäßig eingeschränkt
30–44
Schwer eingeschränkt
<30
Zirkumferenzielle Verkürzungsfraktion oder fractional shortening in der parasternalen langen oder kurzen Achse (FS, eindimensionale Größe; FS = 27–45 (♀), FS = 25–43 % (♂); LVEDD, linksventrikulärer enddiastolischer Diameter; LVESD, linksventrikulärer endsystolischer Diameter):
FS = (LVEDD − LVESD)/LVEDD × 100 %
Anzumerken ist bei dieser Methode, dass vom Kontraktionsverhalten der regionalen Wandabschnitte auf die Funktion des gesamten linken Ventrikels geschlossen wird. Dies ist u. a. bei regionalen WBST nicht zulässig. Die Methode findet heute nur noch selten eine praktische Anwendung.
Linksventrikulärer enddiastolischer Diameter (LVEDD), gemessen in der parasternalen kurzen oder langen Achse (B‑Bild oder korrekt eingestellter M‑Mode senkrecht zum interventrikulären Septum).
Normwerte: <54 mm (♀), <60 mm (♂).
EDV und ESV aus der Simpson-Methode sind ebenfalls geeignet zur Beschreibung der LV‑Größe.
Normwerte:
EDV: 56–104 ml (♀), 67–155 ml (♂),
ESV: 19–49 ml (♀), 22–58 ml (♂).
Diastolische Septumdicke/Dicke der Posterolateralwand (parasternale lange oder kurze Achse) als Parameter der LV‑Muskularisierung bzw. ‑Hypertrophie, auf die Berechnung der Myokardmasse (meist nach der Devereux-Formel) wird in der Notfallsituation verzichtet.
Normwerte: 6–9 mm (♀), 6–10 mm (♂).
Regionale systolische LV‑Funktion
Zur Beurteilung der regionalen Kontraktilität wird entweder das 16- oder 17‑Segmentmodell verwendet. In der Notfallsituation ist allerdings die Berücksichtigung des „apical cap“ als Segment 17 bedeutungslos, welches der Vergleichbarkeit mit radiologischen Schnittbildverfahren dient. Es werden insbesondere die 3 apikalen Schnitte, sowie der parasternale Kurzachsen- und ggf. auch Langachsenschnitt berücksichtigt (◘ Abb. 6.4, Lang et al. 2005). Ursache regionaler WBST ist meist eine koronare Herzerkrankung, im Sinne eines akuten Myokardinfarkts oder eines Z. n. Myokardinfarkt (▶ Kap. 7). Jedoch können auch andere Krankheitsbilder wie beispielsweise eine Myokarditis oder eine dilatative Kardiomyopathie mitunter eine regionale linksventrikuläre Kontraktionsstörung hervorrufen. Die Stressechokardiographie hat eine große Bedeutung bei der Identifikation relevanter Koronarstenosen, ist jedoch in der Regel nicht Bestandteil der Notfalldiagnostik und wird hier nicht näher besprochen.
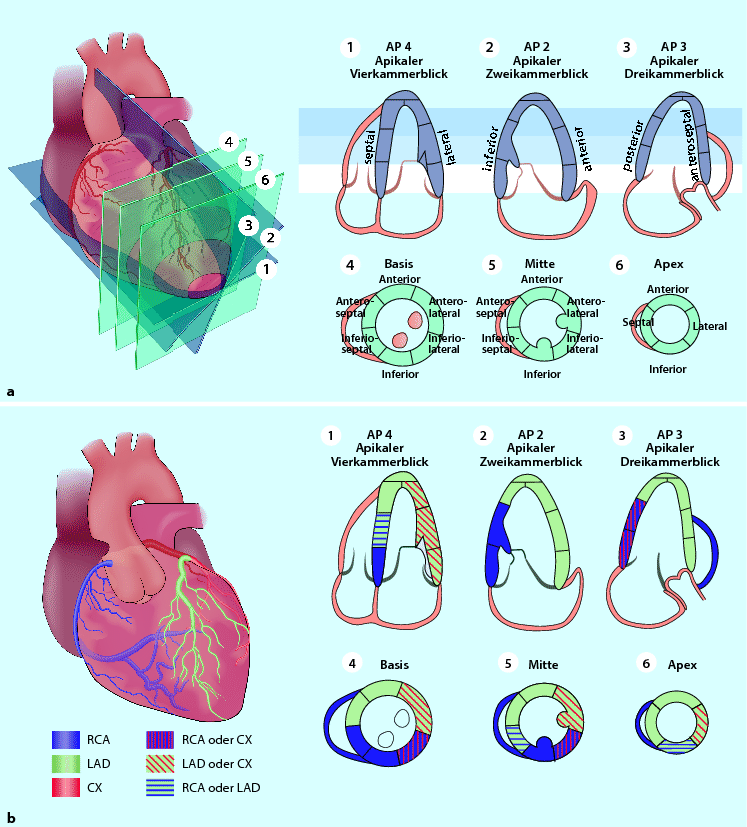
Abb. 6.4
a,b Segmenteinteilung des LV sowie Zuordnung zu Perfusionsterritorien (AP4 apikaler Vierkammerblick, AP2 apikaler Zweikammerblick, AP3 apikaler Dreikammerblick)
Durchführung
Die qualitative Beschreibung der segmentalen Bewegung unter Berücksichtigung von systolischer Einwärtsbewegung und Wanddickenzunahme führt zur Klassifikation als normo‑, hypo‑, a‑, dyskinetisch oder aneurysmatisch (◘ Abb. 6.5).

Abb. 6.5
Einteilung regionaler WBST
Die Positionierung eines Zeigers oder Pfeils im LV‑Kavum an der Grenze zwischen basalen 2/3 und apikalem Kavum-Drittel kann zur Beurteilung hilfreich sein. Alle Myokardsegmente sollten sich auf diesen Punkt zubewegen.
Zur Einteilung gemäß 16- oder 17‑Segment-Modell und Zuordnung zu einem Koronarterritorium, siehe ◘ Abb. 6.4.
6.1.2 Diastolische LV‑Funktion
Obwohl die extensive Quantifizierung der diastolischen Funktion in der Notfallsituation nur eine untergeordnete Rolle einnimmt, möchten wir hier kurz darauf eingehen (◘ Tab. 6.2).
Tab. 6.2
Echokardiographi sche Phasen der Diastole
Phase der Diastole | Beschreibung |
|---|---|
Phase 1: Entspannung/Relaxation | Isovolumetrische Relaxationszeit (IVRT) |
Phase 2: Füllung/Compliance | Schnelle früh‑(Early)‑diastolische Füllung (E‑Welle) |
Phase 3: Füllung/Compliance | Diastase (langsame Ventrikelfüllung) |
Phase 4: Füllung/Compliance | Atriale Kontraktion (A‑Welle) |
Hämodynamisch gesehen führt eine diastolische Dysfunktion zu erhöhten linksatrialen und damit pulmonalkapillären Drucken (gestörte Füllungsphase). Im Rahmen eines hypertensiven Notfalls kann trotz erhaltener systolischer LV‑Funktion aufgrund einer vorbestehenden diastolischen Dysfunktion (heart failure with normal ejection fraction, HFNEF ) eine akute Linksherzinsuffizienz mit Lungenödem auftreten. In der Regel ist eine Kombination aus morphologischen Kriterien und sekundären Veränderungen (LA >20 cm2 bzw. LA‑Volumen >28 ml/m2 Körperoberfläche, apikaler Vierkammerblick, LV‑Hypertrophie?, pulmonale Hypertonie?) und (Tissue)‑Doppler-Parametern (E/e’, e’ Geschwindigkeit, E/A, DT, ◘ Tab. 6.3) ausreichend. Beispielsweise kann in Abwesenheit einer LA‑Dilatation eine chronische Erhöhung des LV‑Füllungsdrucks und LA‑Drucks und damit eine relevante chronische diastolische Dysfunktion bereits ausgeschlossen werden.
Tab. 6.3
Wesentliche echokardiographische Parameter der diastolischen Funktion
Parameter | Normalbefund | Stadium I Relaxationsstörung (Cave: Alter, Tachykardie) | Stadium II Pseudonormalisierung | Stadium III Restriktives Füllungsmuster |
|---|---|---|---|---|
Mitraleinstrom: E/A‑Verhältnis | >1 | <1 | 1–1,5 | >1,5 |
Mitraleinstrom: E‑Wellen DT (ms) | <220 | >200 | 160–200 | >160 |
E/lat e’ | <8 | <8 | 8–12 | >12 |
e’ (cm/s) | >8 | <8 | <8 | <8 |
E E‑Welle, A A‑Welle, DT Dezelerationszeit der E‑Welle, lat e’ laterale Mitralklappenannulusgeschwindigkeit im PW‑/Tissue-Doppler | ||||
Zu beachten ist, dass die Diagnose HFNEF in den allermeisten klinischen Studien auf dem Vorhandensein typischer Herzinsuffizienzsymptome bei (fast) normaler EF (meist echokardiographisch >50 %) beruhte. Der Großteil der Patienten mit HFNEF weist eine arterielle Hypertonie auf, sodass das Zusammentreffen der typischen Klinik einer Herzinsuffizienz mit dem echokardiographischen Nachweis einer relevanten Myokardhypertrophie, einer Dilatation des linken Atriums bei EF >50 % (und Ausschluss anderer infrage kommender Pathologien) die Diagnose HFNEF sehr wahrscheinlich macht.
Zu beachten ist, dass ein eindeutig restriktives Einstromprofil (◘ Abb. 6.6, ◘ Abb. 6.7, ◘ Tab. 6.3) häufig mit anderen Pathologien, wie z. B. einer hochgradigen Mitralklappeninsuffizienz oder einer relevant eingeschränkten systolischen LV‑Funktion assoziiert ist (und prognostisch bedeutsam sein kann).

Abb. 6.6
Restriktives Mitraleinstromprofil: Messung von E, A, E/A, Dezelerationszeit der E‑Welle, PW‑Doppler, apikaler Vierkammerblick

Abb. 6.7
Restriktives Mitraleinstromprofil: Messung von e’ des lateralen Mitralklappenannulus und Berechnung von E/e’, PW‑/Tissue-Doppler, apikaler Vierkammerblick
Eine kurze Anmerkung zum E/A‑Verhältnis: Ein E<A ist im Alter über 60 Jahren und bei Tachykardie physiologisch und kann folglich nicht ohne weiteres als Relaxationsstörung gewertet werden. Dies verdeutlicht erneut, dass potentielle sekundäre Veränderungen (LA‑Dilatation, pulmonale Hypertonie, etc.) bei der Diagnose einer diastolischen Dysfunktion berücksichtigt werden müssen. In der Tabelle (◘ Tab. 6.3) sind einige wesentliche Parameter angegeben, auf die Möglichkeiten des Pulmonalvenendopplers (PVs/PVd‑Verhältnis und insbesondere PVAr‑Aduration) kann nicht eingegangen werden.
6.2 Aorten- und Mitralklappe
Henrik ten Freyhaus, Roman Pfister, Guido Michels
Die Beurteilung der Herzklappen ist auch in der Notfallsituation von großer Bedeutung und muss im Kontext der Symptomatik des Patienten erfolgen. Allgemein gilt, dass die echokardiographische Schweregradbeurteilung eines Vitiums nicht allein mit dem Farbdoppler erfolgt. Die zugrundeliegende Pathologie sollte immer zunächst im B‑Bild gesucht werden; dann sind beispielsweise im Falle einer Insuffizienz meist vor der Benutzung des Farbdopplers Richtung und Ausdehnung des Jets abschätzbar (◘ Abb. 9.4, ◘ Abb. 9.5). Zudem ist die morphologische Beurteilung der entsprechenden Herzklappe mit ihrem Annulus und ggf. Halteapparat zusammen mit weiteren Parametern (z. B. LV‑Funktion, LV‑Dilatation) entscheidend für das weitere Vorgehen.
Dennoch kann in der Notfallsituation die Zeit für eine umfassende echokardiographische Untersuchung der Klappen des linken Herzens fehlen, sodass nur eine orientierende Echokardiographie möglich ist. Auch dann gilt, dass möglichst viele Anlotpositionen verwendet werden sollten, um morphologische Klappenveränderungen darzustellen. Der Fokus kann hier auf die Detektion „großer“ Koaptationsdefekte oder anderer offensichtlicher Ursachen einer Regurgitation, sowie auf eine Klappensklerose, ein Klappen-Doming oder eine eingeschränkte Öffnungsbewegungen gerichtet sein. Dann sollte eine Farbdopplerechokardiographie erfolgen, mit Suche nach (relevanten) Insuffizienzen bzw. Flussbeschleunigungen. Bei morphologischen Hinweisen auf eine Klappenstenose oder unzureichend beurteilbarem B‑Bild sollte der CW‑Doppler verwendet werden, um eine höhergradige Stenose nicht zu übersehen. Immer sind zudem potentiell bestehende sekundäre Veränderungen zu berücksichtigen (LA‑/LV‑Dilatation, LV‑Funktion, LV‑Hypertrophie, etc.). Sollte der Verdacht auf ein „relevantes“ Vitium bestehen, muss nach initialer Stabilisierung des Patienten eine umfassende echokardiographische Untersuchung zur genauen Schweregradbeurteilung erfolgen, wie im Folgenden dargestellt (Buck et al. 2009; Lancelloti P et al. 2010).
6.2.1 Aortenklappenstenose
Die Aortenklappenstenose stellt das häufigste Vitium im (höheren) Erwachsenenalter dar. Bei älteren Patienten kann dieses Vitium anhand der typischen Symptomatik – Angina pectoris und/oder Dyspnoe – nicht von einem akuten Koronarsyndrom unterschieden werden, sodass insbesondere bei entsprechendem Auskultationsbefund eine zumindest orientierende transthorakale Echokardiographie unabdingbar ist.
Die Aortenklappenöffnungsfläche beträgt normalerweise 2,5–3,5 cm2. Eine Klappenöffnungsfläche von <1 cm2 entspricht in der Regel einer hochgradigen Aortenklappenstenose (◘ Tab. 6.4). Bei Vorliegen einer deutlich eingeschränkten systolischen LV‑Funktion kann die Schweregradbeurteilung eine Herausforderung darstellen, da aufgrund der Pumpfunktionsstörung sekundär die Klappenöffnung eingeschränkt sein kann, andererseits die Aortenstenose die Pumpfunktionsstörung bedingen kann. Hier kann abseits der Notfallsituation eine Low-dose-Dobutamin-Stressechokardiographie hilfreich sein.
Tab. 6.4
Grenzwerte bei der Schweregradeinteilung der Aortenklappenstenose
Schweregrad
Stay updated, free articles. Join our Telegram channel
Full access? Get Clinical Tree
 Get Clinical Tree app for offline access
Get Clinical Tree app for offline access

|
|---|